
Abiogenese: Herkunft des Lebens
08.09.23 Hat sich die Minimalzelle weiter entwickelt?
In den Medien wurde in letzter Zeit mehrfach über „die Evolution der einfachsten Zelle“ berichtet (Moger-Reischer et al. 2023; Menne 2023). Es handelt sich um eine Variante des Bakteriums Mycoplasma mycoides, ein im Stoffwechsel reduzierter Endoparasit. Mit 901 Genen ist M. mycoides der kleinste der Wissenschaft bekannte Organismus, der aber nicht selbständig in der Natur, sondern nur im Darm von Wiederkäuern überlebt. Davon leiteten Wissenschaftler durch Kürzungen im Erbgut die sogenannte Minimalzelle, JCVI-syn3B, mit 493 Genen ab (Pelletier et al. 2021). Entwickelte sich diese Variante im Labor nun weiter? Oder geschieht etwas, was wir von sich reproduzierenden Systemen erwarten: die Optimierung der Replikation? Es stellt sich heraus, dass „die Evolution der Minimalzelle“ nichts anderes ist als der Gewinn des Reproduktionswettbewerbs ohne einen Nettogewinn an biologischer Information.
Ein Gedankenexperiment: Was ist Evolution?
Beginnen wir mit einem Gedankenexperiment, um festzustellen, was in der experimentellen Forschung üblicherweise mit „Evolution“ gemeint ist. Wir starten mit einem lebenden Bakterium in einem mit Brühe gefüllten Laborkolben, dem jedoch eine Kohlenstoffquelle fehlt, d. h. wir verwenden eine Brühe, die alle für das Bakterium notwendigen Nährstoffe außer z. B. Glukose enthält. Glukose ist ein Zucker, den das Bakterium als Baustoff- und Energiequelle für die Bildung neuer Zellen verwendet. In einem Medium ohne Glukose wird sich das Bakterium nicht vermehren können; es wird sich nicht teilen. Anschließend stellen wir einen Hebel um, damit Glukose in den Kolben hineinfließen kann. Weil es jetzt eine essenzielle Bau- und Energiequelle gibt, beginnt sich die Mikrobe zu teilen. Unter optimalen Bedingungen benötigt das Bakterium nur zwanzig Minuten, um eine Tochterzelle zu produzieren. Das Bakterienwachstum ist exponentiell. Nach einem Tag haben wir eine Brühe mit Milliarden von Bakterien. Sie sind nicht identisch, weil Bakterien eine natürliche Tendenz zur Veränderung haben. Die Genome (das komplette Erbgut) von Bakterien sind in einem kontinuierlichen State of Flux, das heißt, die Genome werden ständig neu angeordnet. Einige Bakterien können genetisches Material verlieren, während andere Bakterien Teile ihres Genoms verdoppeln. Obwohl das Experiment mit einem einzigen bakteriellen Genom begann, wird nach mehreren Runden Zellteilung keines der bakteriellen Genome gleich sein. Mit einem Mikroskop kann man das zwar nicht feststellen, aber genetisch und biochemisch sind sie verschieden. Sie sind nicht mehr genauso wie das Bakterium, mit dem das Experiment begonnen wurde. Und in der Brühe gibt es nach einem Tag kaum noch zwei Mikroben, die genau gleich sind.
Wenn wir nun den Zu- und Ablauf zu bzw. von dieser Brühe entsprechend regulieren, können wir eine stationäre Kultur schaffen, in der die Zuckerkonzentration und die Bakterienkonzentration konstant sind. Unter diesen Bedingungen ist der einzige relevante Parameter, durch den sich die Bakterien unterscheiden, die Fähigkeit, Glukose im Stoffwechsel zu verarbeiten. Jetzt wird der Organismus mit der kürzesten Teilungsperiode – das ist der schnellste Replikator – in der Häufigkeit zunehmen. Einfache mathematische Überlegungen zeigen, dass die Anzahl der schnellsten Replikatoren viel schneller zunimmt als die der langsameren, so dass erstere nach einiger Zeit die gesamte Population dominieren. Wenn wir die Mikroorganismen weiter kultivieren, stellen wir fest, dass die Mikrobenmasse größtenteils aus schnellsten Replikatoren besteht. Da die Teilungszeit ein messbares Merkmal ist, werden die Biologen nun sagen, dass ein Organismus mit einer erhöhten Fortpflanzungsrate (oder einer verkürzten Fortpflanzungsperiode) evolviert ist. Wenn es einem der Bakterien gelingt, seine Fortpflanzungszeit auch nur minimal zu verkürzen, wird diese Variante nach einer ausreichenden Anzahl von Replikationsrunden die gesamte Kultur ausmachen. Das Ergebnis dieses Gedankenexperiments ist klar: Die Selektion wirkt sich dahingehend aus, wie schnell sich Organismen innerhalb einer Population vermehren.
Erweitern wir das Experiment: Was würde passieren, wenn wir ein Antibiotikum, das die Reproduktion der Mikroben beeinträchtigt, in das System einführen würden? Es ist jetzt nicht nur wichtig, Glukose abbauen zu können, sondern ebenso wichtig, mit diesem Antibiotikum umgehen zu können. Wir lassen den Glukose-Zufluss unverändert und beginnen mit der Zugabe von Antibiotika in einer sehr niedrigen Konzentration. Wenn wir zu viel auf einmal hinzufügen, würden alle Mikroben sofort sterben. Um eine natürliche Selektion zu realisieren, müssen wir mit einer geringen Konzentration an Antibiotika beginnen, damit genügend Mikroben am Leben bleiben. Obwohl die Teilungszeit aufgrund des Vorhandenseins des Antibiotikums etwas länger ist, wird es immer noch einige Bakterien geben, die sich schneller vermehren als andere und dadurch mehr Nachkommen produzieren als die anderen Bakterien. Und wieder sind es die schnellsten Zellteiler, die nach gewisser Zeit in der gesamten Zuchtkultur vorherrschen werden. Anscheinend ist das Tempo, mit dem sich Organismen unter den gegebenen Umständen multiplizieren, das Auslesekriterium. Es stellt sich heraus, dass die Reproduktionsfähigkeit – Evolutionsbiologen reden von Fitness – immer das Kriterium ist, welches das Ergebnis der Auslese-Experimente bestimmt, zumindest in Bakterienkulturen unter den gegebenen Randbedingungen.
Das Replikatorgesetz
Mit diesen Gedankenexperimenten haben wir eine wesentliche Gesetzmäßigkeit reproduzierender Systeme verdeutlicht: Die Auslese (Selektion) begünstigt unter sonst gleichen Bedingungen diejenigen Organismen, die sich am schnellsten vermehren. Das ist auch in natürlichen Populationen so. Die Existenz einer Population wird letztlich nur gesichert durch Fortpflanzung. „Reproduziere oder krepiere“ ist ein wichtiger biologischer Grundsatz. Würde die Reproduktionsrate die Sterberate nicht übertreffen, wäre eine Population von Organismen schnell dezimiert und würde schließlich aussterben. Dieses Gesetz gilt für alle biologischen Systeme und Populationen, sonst würden wir diese Lebewesen nicht vorfinden. Es gilt für rezidivierende (wiederkehrende) Krebszellen, für die klonale Selektion von Immunzellen, für Viren, und ebenso für die Bildung von Geschlechtszellen. Die schnellsten Replikatoren gewinnen immer das Rennen! Nicht die komplexesten Varianten, die die meisten Gene besitzen, sondern die, die sich (unter den vorherrschenden Umweltbedingungen) am schnellsten vermehren, gewinnen. Dies ist das Prinzip des Überlebens des Fittesten („survival of the fittest“).
Die Forscher, die in der Zeitschrift Nature über die Evolution der Minimalzelle berichteten, stellten fest, dass die Minimalzelle, JCVI-syn3B, eine außergewöhnlich hohe Mutationsrate aufweist (Moger-Reischer et al. 2023). Dies ist nicht überraschend, da alle Gene, die nicht direkt für die Fortpflanzung benötigt werden, in dieser Variante entfernt wurden, also auch diejenigen Gene, die normalerweise die DNA ordnungsgemäß reparieren würden. Durch diesen Wegfall treten Mutationen häufiger auf. Außerdem stellten sie fest, dass der neue Stamm im Vergleich zu den ursprünglichen Minimalzellen (Ausgangsstamm JCVI-syn3B) eine um 39 Prozent höhere Reproduktionsrate aufwies: Als die Evolutionsbiologen die „weiterentwickelten“ Zellen mit „ursprünglichen“ Minimalzellen kultivierten, übernahmen die „weiterentwickelten“ JCVI-syn3B die Kontrolle und verdrängten sie. Die Autoren schreiben, dass der neu entwickelte Stamm „die gesamte Fitness“ wiedererlangt hat, die verloren ging, als das Genom künstlich verkleinert wurde und dadurch viele seiner Gene verloren gingen.
Es ist offensichtlich, dass der Begriff „Fitness“ mit der Reproduktionsrate unter den gegebenen, in diesem Fall künstlichen, Umweltbedingungen korreliert und nicht mit dem Erwerb neuer Fähigkeiten. Die Daten dieses Laborexperiments stimmen also mit dem überein, was wir nach dem Gesetz der sich reproduzierenden Systeme erwarten würden: Die Selektion betrifft immer die Reproduktionsrate. Die schnellsten Replikatoren ersetzen die jeweils langsameren (Borger 2018).
Schlussfolgerung
Für einen innovativen Evolutionsprozess, in dem sich der Mensch aus niederen Organismen entwickelt hat, muss es einen kontinuierlichen Eintrag neuer genetischer Informationen geben, also codierte Anweisungen, die dem Organismus einen Fortpflanzungsvorteil (erhöhte Fitness) verschaffen. Mit anderen Worten: Sie erfordert neue biologische Information und damit auch neuartige Gene. In der Veröffentlichung in Nature werden weder neue Gene noch neue codierte Information oder neue genetische Anweisungen erwähnt. Letztes Jahr, als der Vorabdruck dieses Artikels bei BioArXiv veröffentlicht wurde, habe ich mich mit den Autoren in Verbindung gesetzt und sie gefragt, ob die beobachtete erhöhte Fitness mit der Evolution neuer Gene zusammenhängt. Leider haben sie auf meine wiederholte Bitte, meine einfache Frage zu beantworten, nie geantwortet. Ich vermute daher, dass dieses Experiment, das eine erhöhte Fitness zeigt, nicht mit neuen Genen verbunden ist. Demgemäß bestätigt dieses Experiment nur das Gesetz der Replikatoren. Mit innovativer Evolution hat es nichts zu tun. Die JCVI-Syn3B Zellen haben sich also nicht innovativ weiterentwickelt, sondern lediglich ihre Replikationszeit verkürzt, wie man es nach dem oben beschriebenen Replikatorgesetz erwarten würde. Innovative Evolution ist nicht einfach nur eine erhöhte Reproduktionsrate. Von einer tatsächlichen Weiterentwicklung könnte nur gesprochen werden, wenn die Reproduktionsrate mit einer erhöhten biologischen Komplexität einherginge. Das ist aber nicht die beobachtete biologische Realität, sondern lediglich eine Annahme.
Quellen
Borger P (2018) Darwin Revisited – Or how to understand Biology in the 21st century. Scholars Press, pp 30–45.
Moger-Reischer RZ et al. (2023) Evolution of a minimal cell. Nature 620, 122–127, https://www.nature.com/articles/s41586-023-06288-x.
Menne K (2023) Auch mit wenig Erbgut gelingt Evolution. Spektrum. News 08.07.2023, https://www.spektrum.de/news/auch-mit-wenig-erbgut-gelingt-evolution/2157744.
Pelletier JF et al. (2021) Genetic requirements for cell division in a genomically minimal cell. Cell 184, 2430–2440, https://doi.org/10.1016/j.cell.2021.03.008.
Autor dieser News: Peter Borger
© 2023, http://www.genesisnet.info/schoepfung_evolution/n319.php
Zurück zur Artikel-Übersicht: https://www.wort-und-wissen.org/publikationen/genesisnet/
22.06.23 Die Sauerstoffkatastrophe: Revolution oder Storytelling?
Nach gängiger Evolutionslehre soll in der «großen Sauerstoffkatastrophe» vor 2,4 Milliarden Jahren die Erdatmosphäre mit Sauerstoff angereichert worden sein. Doch Indizien sind dürftig und die Probleme groß.
Viele Dinge, die wir für selbstverständlich halten, erweisen sich bei näherer Betrachtung als überaus staunenswert. Da ist zum Beispiel der Umstand, dass das Universum dank einer äußerst exakt eingestellten Architektur von Naturgesetzen besteht oder die verwunderliche Tatsache, dass dies anhand der Sprache der Mathematik für uns Menschen verstehbar ist. Im Hinblick auf Letzteres sprach der Physik-Nobelpreisträger Eugene Wigner von «einem Geschenk, das wir weder verstehen noch verdienen». Ebenso wenig Verwunderung gibt es bezüglich der Zusammensetzung der Erdatmosphäre. Unzählige Menschen atmen ihr ganzes Leben lang Tag für Tag, ohne sich auch nur einen Moment bewusst zu werden, dass wir dies einer absolut einmaligen, privilegierten Situation unseres Planeten zu verdanken haben: dem hohen Atmosphärenanteil an molekularem Sauerstoff (O2) von knapp 21 Prozent. Das chemische Element Sauerstoff ist im Universum zwar vergleichsweise häufig, doch liegt es nur sehr selten in der molekularen Form vor. Und ausgerechnet auf unserem Planeten haben wir so viel davon.
Das Molekül O2 weist einige Besonderheiten auf: Es ist chemisch eher labil und geht leicht Reaktionen mit anderen Molekülen ein. Es würde daher relativ schnell verschwinden, wenn es nicht durch Organismen ständig nachproduziert wird. Aufgrund seiner Eigenschaften ist O2 für Lebewesen beides zugleich: Segen und Fluch – lebensnotwendig und doch ein Gift. Dabei ist nicht O2 selbst giftig, sondern dessen Abbauprodukte in der Zelle, die wegen ihrer hohen chemischen Reaktivität als reaktive Sauerstoffspezies (reactive oxygen species, ROS) bezeichnet werden. ROS gehen leicht chemische Reaktionen mit vielen Proteinen und DNA ein und verändern dadurch deren Struktur und Funktion. Die Belastung von Lebewesen durch ROS wird als «oxidativer Stress» bezeichnet und ist der hauptsächliche Grund dafür, dass Lebewesen altern. Um es bildhaft zu beschreiben: Wir rosten ständig – ob wir rasten oder nicht. Darüber hinaus darf es weder zu wenig noch zu viel Sauerstoff in der Atmosphäre geben. Sinkt der Volumenanteil an O2 unter 17 Prozent, überleben viele Organismen nicht lange. Steigt der Anteil auf 30 Prozent oder mehr, kommt es häufig zu spontanen Waldbränden. Es stellt sich also die naheliegende Frage: Wie ist es dazu gekommen, dass die Erdatmosphäre einen so hohen Gehalt an O2 hat?
Die große Sauerstoffkatastrophe
Da molekularer Sauerstoff von Organismen (Pflanzen, Cyanobakterien, Kieselalgen) erzeugt wird, liegt es nahe, dass dessen Ursprung mit der Herkunft des Lebens zusammenhängt. Die Standardantwort auf Lebensursprungsfragen in Wissenschaft, Medien und Bildungsinstituten lautet aktuell «Evolution». Aus simplem soll durch natürliche Vorgänge komplexes geworden sein, aus defizitärem vollkommenes. Aus kleinen organischen Molekülen sollen durch chemische Reaktionen Bausteine des Lebens entstanden sein, die sich anschließend zu hochkomplexen Zellen organisierten. Es gibt eine große Vielfalt an untereinander konkurrieren Erklärungsversuchen, wie das geschehen sein soll. Einigkeit besteht lediglich darin, dass der Ursprung des Lebens ausschließlich in natürlichen Prozessen verortet werden kann.
O2 stellt dabei jedoch ein schwerwiegendes Problem dar, da es die Entstehung molekularer Bausteine des Lebens wie Proteine, DNA (Erbgutsubstanz), Vitamine, Fette und Zucker wirksam verhindert. Viele organische Moleküle, aus denen die Bausteine des Lebens entstehen könnten, reagieren nämlich unter Abgabe von Elektronen an O2. Dadurch verändern sich ihre Gestalt und chemische Eigenschaften derart, dass sie nicht mehr zu Proteinen, DNA etc. reagieren können. Ebenso neigen aber auch die Bausteine des Lebens selbst zu Elektronenübertragungsreaktionen mit Sauerstoff, sodass sie in einer sauerstoffreichen Atmosphäre nicht lange erhalten bleiben können. Der Glaube an eine Entstehung erster Zellen durch eine Verkettung chemischer Reaktionen (chemische Evolution) setzt daher zwingend voraus, dass die frühe Erdatmosphäre höchstens äußerst geringe Mengen O2 enthielt. Davon waren auch die Pioniere der Lebensursprungsforschung A. I. Oparin und J. B. S. Haldane in den 1920er Jahren überzeugt – ohne ihre Hypothesen experimentell geprüft zu haben. Oparins Werk beeinflusste maßgeblich die berühmt gewordenen Miller’schen «Ursuppen-Experimente» in den 1950er Jahren, die damals eine große Euphorie unter Wissenschaftlern und Journalisten auslösten. Die Entstehung zweier biologisch relevanter Aminosäuren in nennenswerter Menge und einiger weiterer Aminosäuren in Spurenmengen waren ausreichend für eine weltweite Begeisterung in der Wissenschaftler-Community. Dass S. L. Miller dabei ebenso wie Oparin eine sauerstofffreie Erdatmosphäre zu Beginn der Erdgeschichte annahm, weil er die Entstehung erster Organismen durch chemische Evolution einfach voraussetzte, war offenbar kein Hinderungsgrund für die breite Akzeptanz der Hypothese.
Miller selbst kündigte nach seinen Versuchen optimistisch an, dass das wohl größte Rätsel der Wissenschaft – die Frage nach dem Ursprung des Lebens – in circa 25 Jahren gelöst werden würde. Gegen Ende seiner Laufbahn gestand er allerdings ein, dass alle Hypothesen zum Ursprung des Lebens nicht überzeugend seien. Miller bezeichnete sie als «Unsinn» oder «chemische Kopfgeburten».1 Von der breiten Öffentlichkeit wurden solche Einsichten aber nicht wahrgenommen und das evolutionstheoretische, als wissenschaftlich bezeichnete Narrativ etablierte sich praktisch kritiklos. Nur wenige wundern sich über die durchweg positive Darstellung der Miller-Experimente. Der Hamburger Professor für Polymerchemie, Hans R. Kricheldorf, äußert dazu eine ansonsten kaum vertretene Position: «Fasst man die […] Kritikpunkte zusammen, bleibt nur die Schlussfolgerung, dass die Versuche von Miller vor allem gezeigt haben, wie eine chemische Evolution von Proteinen nicht stattgefunden haben kann. Es ist schon erstaunlich, dass auch noch in Büchern, die in den letzten 20 Jahren geschrieben wurden, die Miller‘schen Experimente nur in positivem Licht präsentiert werden […]»2 (Hervorhebungen hinzugefügt).
Inzwischen halten viele Wissenschaftler es für unkontrovers (besser «gegeben»?), dass vor etwa vier Milliarden Jahren, als die ersten Organismen entstanden sein sollen, eine nahezu sauerstofffreie Atmosphäre den Erdball umschloss. Im Verlauf von ungefähr einer Milliarde Jahren sollen Einzeller entstanden sein, die mithilfe einer angeblich primitiven Form der Photosynthese Licht als Energiequelle nutzten, ohne dabei Sauerstoff zu erzeugen. Durch Evolution sollen dann Photosynthese betreibende Organismen entstanden sein, die Sauerstoff als Abfallprodukt generierten. Diese Kleinstlebewesen werden aktuell mehrheitlich als Cyanobakterien identifiziert. Sie sollen vor ca. 2,4 Milliarden Jahren eine Anreicherung der Atmosphäre mit Sauerstoff bewirkt haben – und folglich ein Massensterben nicht Sauerstoff-resistenter Organismen. Dieser hypothetische Vorgang wird als «große Sauerstoffkatastrophe» oder auf Englisch als «Great Oxygenation Event» bezeichnet.
Aus der Perspektive der Evolutionslehre kann die Relevanz dieses angenommenen Ereignisses kaum überschätzt werden. Glaubt man an eine gemeinsame Abstammung aller Lebewesen, dann ist die Entwicklung der Sauerstoff-generierenden Biochemie bedeutend wichtiger als diejenige des Skeletts von Wirbeltieren oder des Vogelflugs. Dementsprechend sparen Autoren wissenschaftlicher Fachartikel nicht an rhetorischen Zuspitzungen, wenn sie auf die Bedeutung der «großen Sauerstoffkatastrophe» zu sprechen kommen. Beispielsweise beschreiben die Biologen Hohmann-Marriott und Blankenship das hypothetische Szenario in einem Artikel wie folgt: «Die Erfindung der sauerstofferzeugenden Photosynthese und der anschließende Anstieg des atmosphärischen Sauerstoffs vor etwa 2,4 Milliarden Jahren haben die energetischen und enzymatischen Grundlagen des Lebens revolutioniert»3 (Hervorhebungen hinzugefügt).
Eigentlich fällt die Frage, ob es zu Beginn der Erdgeschichte eine sauerstofffreie Atmosphäre gab und später eine Anreicherung mit Sauerstoff stattfand, stärker in den Zuständigkeitsbereich von Geowissenschaftlern als Chemikern oder Biologen. Doch unter Geologen vor der Zeit von S. L. Miller war die Lehrmeinung, es habe eine große Sauerstoffkatastrophe vor 2,4 Milliarden Jahren gegeben, unbekannt. Erst nach dem Rummel um die Miller-Experimente in den 1950er Jahren gewann diese Sichtweise an Bedeutung. Eine der frühesten Arbeiten zu diesem Thema stammt aus dem Jahr 1965.4 Die Autoren der Arbeit spekulierten, dass der Anstieg der Sauerstoffkonzentration einige Entwicklungssprünge in der Evolution erklären würde und es ermögliche «die Geschichte der Erde aus einer ganz neuen und fortschrittlicheren Perspektive zu betrachten».
Indizien?
Befunde, die als Indizien für die «größte biologische Revolution» gewertet werden sind eher bescheiden und alles andere als sicher. Fossil erhaltene Mikroorganismen sind sehr selten und erlauben keine sicheren Schlussfolgerungen bezüglich ihrer biochemischen Ausstattung. Daher beruhen Hypothesen zur «Sauerstoffkatastrophe» allesamt auf indirekten Rückschlüssen aus chemischen Markern, das heißt dem Vorkommen bestimmter Mineralien oder dem Verteilungsmuster von Isotopen in Gesteinsschichten. Für einen wichtigen «Zeugen» der Sauerstoffanreicherung der Erdatmosphäre halten viele das Vorkommen von mächtigen Gesteinsschichten mit einem hohen Anteil an dem eisenhaltigen Mineral Hämatit – so genannte präkambrische Bändereisenerze. Es wurde vermutet, dass diese Schichten in der frühen Erdgeschichte durch Reaktion eisenhaltiger Erdkrustenbestandteile mit dem entstehenden Sauerstoff gebildet wurden. Allerdings gibt es auch einige andere Prozesse, die zur Entstehung solcher Gesteinsschichten beitragen können – sogar die Stoffwechselaktivität bestimmter Bakterien. Daher geben einige Wissenschaftler zu, dass es unklar ist, wie Bändereisenerze entstanden sind.
Ähnlich verhält es sich auch mit einigen anderen geochemischen Markern. Ihre Interpretation als Hinweise auf eine «Sauerstoffkatastrophe» ist alles andere als zwingend. Nicht selten eilt zudem die Verwendung einer Methode der gründlichen Kenntnis der zugrundeliegenden Mechanismen voraus, wie zwei Wissenschaftler über die Auswertung von Isotopenmustern des Schwefels berichten: «Die Unsicherheiten [der Methode] haben ihre Verwendung als geochemische Marker jedoch nicht verhindert …»5
Probleme
Der spekulative Charakter dieser Forschungsrichtung ist deutlich erkennbar an den aufgestellten Modellen für den Verlauf des Atmosphärenumschwungs. Einige sprechen von mehreren Sauerstoff-Schüben, die der endgültigen allmählichen Anreicherung im Zuge von etwa einer Milliarde Jahre vorangegangen sein sollen. Andere befürworten dagegen eine schnelle Änderung der Zusammensetzung der Erdatmosphäre im Verlauf von 1-10 Millionen Jahren. Es gibt eine Bandbreite an weiteren Schätzungen, die zwischen den zwei genannten Dauern des Übergangs liegen. Auch hier kann gesagt werden, dass die Einigkeit unter vielen Wissenschaftlern lediglich darin besteht, dass es einen solchen Übergang gegeben haben soll.
Ein weiteres schwerwiegendes Problem ist die notwendige, aber unhaltbare Annahme, die Photosynthese sei durch Evolution entstanden. Notwendig ist diese Annahme, da ohne Photosynthese kein molekularer Sauerstoff beständig nachgebildet werden kann. Die molekularen Apparate, welche die Photosynthese ermöglichen, sind jedoch derart komplex in ihrem Aufbau und effizient in ihrer Funktionsweise, dass eine Entstehung durch evolutionäres «trial and error» völlig absurd erscheint. Jüngste Untersuchungen zeigen, dass der Energietransfer von Photonen (Lichtteilchen) auf Elektronen in den Photosyntheseapparaten mit einer Effizienz von 99 Prozent einhergeht.6 Von solchen Konstruktionen können Ingenieure nur träumen. Darüber hinaus versetzt die Gesamtarchitektur der Photosyntheseapparate Wissenschaftler immer wieder in tiefes Staunen. Winzige Abweichungen um einige Angström (ein Angström entspricht dem zehnmillionsten Teil eines Millimeters) von der räumlichen Anordnung der Bauteile würden das System funktionsuntüchtig machen. Das liegt daran, dass bestimmte Elektronenübertragungen (Quantentunnel-Prozesse) nur auf sehr kurzen Distanzen funktionieren.
Außerdem ist der Sauerstoff, wie schon erwähnt, ein Zellgift und die Ursache für so genannten «oxidativen Stress». Versuche an E. coli Bakterien haben gezeigt, dass die Hälfte aller wichtigen Organe in nur 20 Minuten beschädigt wird. Daher besitzen alle Lebewesen zugleich mehrere hochkomplexe Abwehr- und Reparaturmechanismen gegen «oxidativen Stress». Wenn also die ersten Kleinstlebewesen Sauerstoff-erzeugende Photosyntheseapparate generiert haben sollen, müssten sie zuvor bereits über die entsprechenden biomolekularen Schutzvorrichtungen verfügt haben. Wenn es aber vorher keinen molekularen Sauerstoff gab, dürfte der Grund fehlen, solche Schutzvorrichtungen zu evolvieren.
Unsere sauerstoffreiche Atmosphäre ist nach bisherigem Wissen im Universum einmalig. Die Erklärung ihrer Entstehung durch Evolution erscheint unhaltbar. Vielmehr bezeugen die zutiefst faszinierenden Zusammenhänge und intelligent angelegten Systeme sowohl in der Geosphäre als auch in den Lebewesen das Werk eines genialen Schöpfers.
Literatur
- J. Horgan (2000), An den Grenzen des Wissens – Siegeszug und Dilemma der Naturwissenschaften, Fischer Taschenbuch.
- H. R. Kricheldorf (2019) Leben durch chemische Evolution? Eine kritische Bestandsaufnahme von Experimenten und Hypothesen. Springer Spektrum, Berlin.
- M. F. Hohmann-Marriot & R. E. Blankenship (2011) Evolution of Photosynthesis. Annu Rev. Plant Biol. 62, 515–548.
- L. V. Berkner & L. C. Marshall (1965), On the Origin and Rise of oxygen concentration of Earth‘s atmosphere, J. Atmospheric Sciences, 22, 225–261.
- N. Dauphas & E. A. Schauble (2016) Mass-independent effects, and isotopic anomalies. Annu. Rev. Earth. Planet. Sci. 44, 709–783.
- R. Croce & H. van Amerongen (2020) Light harvesting in oxygenic photosynthesis: structural biology meets spectroscopy. Science 369, doi:10.1126/science.aay2058.
Dieser Artikel ist unter ähnlicher Überschrift in der Zeitschrift factum 22/6 (https://factum-magazin.ch/) erschienen und wurde uns freundlicherweise zur Verfügung gestellt.
Autor dieser News: Boris Schmidtgall
© 2023, http://www.genesisnet.info/schoepfung_evolution/n317.php
Zurück zur Artikel-Übersicht: https://www.wort-und-wissen.org/publikationen/genesisnet/
25.10.21 Evolution der Mehrzelligkeit im Labor: vorprogrammierte Anpassung gegen Fressfeinde?
Aus evolutionstheoretischer Sicht ist die Entstehung der Mehrzelligkeit eine Notwendigkeit für die Evolution höherer Organismen, weil sie die Aufgabenteilung zwischen verschiedenen Zellgruppen ermöglicht. Nach der vorherrschenden Lehrmeinung haben sich mehrzellige Organismen 20-30 mal unabhängig voneinander entwickelt. Daher sollte dieses Merkmal ganz einfach entstehen können. In einer neuen Studie mit Grünalgen wurde kürzlich berichtet, dass sich die Mehrzelligkeit im Labor in weniger als 500 Generationen entwickelt hat. Ein genauer Blick auf die Daten zeigt jedoch, dass es sich um eine programmierte Anpassung handelt, die in der Gegenwart von Raubtieren induziert und/oder selektiert wird.
Kürzlich wurde in Nature Communications eine Arbeit mit einem etwas schwer verständlichen Titel veröffentlicht: „The evolution of convex trade-offs enables the transition towards multicellularity“ (Übersetzt: Die Evolution konvexer Trade-offs ermöglicht den Übergang zur Mehrzelligkeit). (Bernardes 2021). Es geht dabei um den Übergang von Einzelligkeit zu Vielzelligkeit.
Der Begriff „Trade-off“ lässt sich am besten mit „Ausgleich“ oder „Abhängigkeit“ übersetzen und ist der englische Begriff für eine gegenläufige Abhängigkeit, d.h. nimmt die eine Größe zu, dann nimmt zugleich die andere ab. Um welchen Trade-off handelt es sich hier? Anders gesagt: was genau ist hier die Abhängigkeit? Die Wissenschaftler fanden heraus, dass sich die Algen in Zellverbänden zwar weniger stark reproduzierten als die einzelligen Varianten, sie das aber durch eine höhere Gesamtüberlebensrate ausgleichen.
Herausforderungen der Vielzelligkeit
Im Rahmen der Evolutionslehre wird davon ausgegangen, dass Mehrzelligkeit entstand, als sich Einzeller in Kolonien zusammenschlossen, um ihre Überlebenschancen zu erhöhen. Dies wird heutzutage auch bei Bakterien in Biofilmen beobachtet. Damit aus einer Einzeller-Kolonie aber ein höherer Organismus entsteht, bedarf es einer ganzheitlichen Umstrukturierung der Zellen, denn die Vielzelligkeit stellt große physikalische und biologische Herausforderungen dar. Zudem muss auch ihr genetisches Informationssystem neu organisiert werden, damit die Programme in den verschiedenen Zellen reguliert werden können. Dies geschieht durch epigenetische Programmierung. Außerdem müssen die Zellen aufeinander abgestimmt sein und miteinander kommunizieren. Große Organismen können nicht einfach als riesige Einzeller existieren, die zu immensen Größen heranwachsen, weil biophysikalische Gesetzmäßigkeiten (Diffusion, Austausch von Signalen usw.) und bioenergetische Beschränkungen (abnehmendes Volumen-Oberflächen-Verhältnis) dies unmöglich machen. Um diese physikalischen Probleme zu überwinden, bedarf es präziser Lösungen. Die zu erfüllenden Funktionen müssen auf verschiedene Zellen aufgeteilt werden, wozu es einer genauen Organisation bedarf. In einzelligen eukaryotischen Organismen geschieht dies mit Hilfe von Organellen wie z. B. Mitochondrien, die auf die Energiegewinnung spezialisiert sind. Um größere Organismen zu bilden, sind spezialisierte Zellgruppen, Gewebe und Organe erforderlich, also mehrzellige Systeme aus spezialisierten Zellen. Mehrzelligkeit ist also eine notwendige Voraussetzung für alle höheren Lebensformen, und dies erfordert neben einem völlig anderen Zelltyp (mit Zellkern und Zellorganellen) auch Abstimmungen zwischen den verschiedenen Zelltypen.
Wie entstand die Vielzelligkeit im Experiment?
Ausgangspunkt für die Studie von Bernardes et al. waren Einzelzelllinien der Grünalge Chlamydomonas reinhardtii, ein kernhaltiger, eukaryotischer, photoautotropher Organismus mit allen erforderlichen Zellorganellen. Sie wurden in An- beziehungsweise Abwesenheit eines Räubers, des Rädertierchens Brachionus calyciflorus, jeweils sechs Monate lang in einem Medium kultiviert. Nach sechs Monaten (das entspricht etwa 500 Generationen) zeigten alle zehn Zelllinien, die in Anwesenheit des Rädertierchens wuchsen, Kolonien, während in Abwesenheit des Räubers nur 4 von zehn diese Eigenschaft entwickelten. Was bedeuten diese Befunde für die Evolution der Vielzelligkeit? Überhaupt nichts. Es ist vielmehr ein weiteres Beispiel für die Selektion von Merkmalen, die schon zuvor vorhanden waren und dadurch leicht abgerufen werden können, wenn die Algen durch Räuber befallen werden.
Eine naheliegende Frage ist, warum die Forscher mit Chlamydomonas reinhardtii begonnen haben, um die Evolution der Vielzelligkeit zu dokumentieren. Diese Gattung (Chlamydomonas) ist dafür bekannt, dass sie unter Stressbedingungen mehrzellig werden kann. Die Bildung von Zellgruppen in C. reinhardtii kann zum Beispiel durch organische Säuren oder Salzstress ausgelöst werden, schreiben die Autoren. Handelt es sich also um ein bereits vorhandenes, vorprogrammiertes Merkmal, das ohne weiteres aktiviert werden kann? Und damit um einen Weg, der in Gegenwart von Fressfeinden leicht gefunden werden kann, wie der Evolutionsbiologe Andreas Wagner ausführlich darlegte? (Wagner 2017). Was wäre passiert, wenn die Wissenschaftler um Bernardes von einem Einzeller ausgegangen wären, von dem wir wissen, dass die Gattung, der er angehört, nicht in der Lage ist, Mehrzelligkeit zu erzeugen? In „The edge of evolution“ sagt Michael Behe voraus, dass sich nichts entwickeln wird, was mehr als vier gleichzeitig auftretende zufällige Mutationen erfordert. Wenn die Evolution der Vielzelligkeit innerhalb dieser Reichweite liegt, sollte sich das Merkmal nach Behe entwickeln können. Sie kann dann als ein vorgegebener Weg betrachtet werden, der Lebewesen hilft, in Stresssituationen zu überleben. Experimentell wäre festzustellen, ob die Veränderung umkehrbar ist, d. h. ob sie mit der Zeit verschwinden und wieder auftauchen kann. Die Umkehrbarkeit würde mit dem übereinstimmen, was wir von einem molekularbiologischen Mechanismus, wie z. B. der Umlagerung von Transposonen*, erwarten würden. Leider gibt es hierzu bisher keine Daten.
*Transposonen (= Genetisches Element (DNA-Sequenz), das sich im Genom umlagern und somit neue genetische Zusammenhänge erzeugen kann)
Programmierung der Anpassung
Bei verschiedenen Stämmen fanden die Forscher dasselbe Merkmal der Entstehung von Kolonien, das sich mehrmals unabhängig voneinander entwickelte. Dies zeigt, dass diese Anpassung an Fressfeinde kein zufälliger Prozess ist, sondern vorprogrammiert. Von Beginn des Experiments an war klar, dass diese Anpassung in der Population stattfinden würde. Das ist etwas anderes als die ursprüngliche Idee, dass die Wege der Evolution nicht vorhergesagt werden können. Neuere Studien zur molekularen Evolution zeigen ein ähnliches Ergebnis. In dem bekannten Langzeitevolutionsexperiment mit E. Coli Bakterien von Richard Lenski wurde ebenfalls beobachtet, dass mindestens zwei Linien separat evolvierender Bakterien unabhängig voneinander zu genau demselben Genregulationsmuster gelangten. Unter mehreren Tausend Genen, die im Genom der beiden Bakterienlinien vorhanden sind, befanden sich lediglich 59, deren Aktivität sich im Lauf des Experiments geändert hatte. Ihre Aktivitäten waren aber nicht willkürlich verändert. Stattdessen war die Exprimierung (= Ablesen und Nutzen von Genen) der Gene in beiden Organismen auf genau dieselbe Weise verändert. Wenn die Aktivität eines bestimmten Gens in Stamm eins zugenommen hatte, dann war das auch in Stamm zwei auch der Fall. Wenn die Aktivität eines anderen Gens in Stamm eins verringert war, dann war das auch in Stamm zwei der Fall – dieses Muster wurde öfter beobachtet. Lenskis Ergebnisse waren beachtenswert, da die genetischen Änderungen eine vorgegebene Richtung anzustreben schienen. (Cooper 2003).
Um die Vielzelligkeit in Grünalgen zu bewirken, war ebenfalls nur die Veränderung einer begrenzten Anzahl von Genen erforderlich. Transkriptomunterschiede zwischen Zellgruppen und Einzelzellen ergaben 76 unterschiedlich exprimierte Gene (57 hochregulierte und 19 herunterregulierte in Gruppen-bildenden Grünalgen). Und der begrenzte Zeitrahmen des Experiments von nur sechs Monaten (<500 Generationen) für die Entwicklung der Mehrzelligkeit ist extrem schnell und bedarf keiner großen Zeiträume, wie sie oft für die Darwin’sche Evolution postuliert werden. Kann dies aber durch Mutation und Selektion geschehen? Obwohl die Forscher eine Sequenzierung des gesamten Genoms durchgeführt haben, berichten sie nicht über die Beteiligung von transponierbaren Elementen, die in Lenskis Experiment die meisten der adaptiven Phänotypen hervorgerufen haben. Dennoch sind sich die Autoren dieser Arbeit darüber im Klaren, dass es sich nicht um einen zufälligen Prozess handeln kann. Die Autoren kommen zu dem Schluss, dass „der ziemlich hohe Grad an Wiederholbarkeit und die geringe Anzahl an Generationen auf einen gewissen Grad an Determinismus für die phänotypische und genomische Reaktion von C. reinhardtii auf Durck durch Fressfeinde schließen lassen.“
Das ist eine beeindruckende Aussage, die in der Wissenschaftspresse zu diesem Thema so nicht zu lesen war (Bernard 2021). Vorhersagbare genetische Veränderungen in der Genexpression sind auch bei den Flügelmustern von Schmetterlingen zu beobachten (Larter 2018). Ist also Abruf vorhandener Programmierungen die Erklärung, die die Evolutionsbiologie liefern kann, nachdem die Molekularbiologie und die genetischen Mechanismen der Anpassung aufgedeckt wurden? In der Tat zeigt die neue Ära der Molekularbiologie immer deutlicher, dass Anpassungen im Voraus festgelegt sind! Dies steht im Einklang mit der Hypothese, dass das Leben das Produkt eines vorausschauenden Designers ist.
Quellen
Bernard E (2021) Evolution in Echtzeit. Einzellige Grünalge vollzieht in nur 500 Generationen die ersten Schritte zur Mehrzelligkeit. https://www.scinexx.de/news/biowissen/evolution-in-echtzeit/
Bernardes JP et al. (2021) The evolution of convex trade-offs enables the transition towards multicellularity. Nat. Comm. 12, 4222, https://doi.org/10.1038/s41467-021-24503-z
Cooper TF, Rozen DE & Lenski RE (2003) Parallel changes in gene expression after 20,000 generations of evolution in Escherichiacoli. Proc. Natl. Acad. Sci. USA 100, 1072–1077.
Larter M, Dunbar-Wallis A, Berardi AE & Smith SD (2018) Convergent Evolution at the Pathway Level: Predictable Regulatory Changes during Flower Color Transitions. Mol. Biol. Evol. 35, 2159–2169.
Wagner A (2014) Arrival of the fittest. One World Publications.
Autor dieser News: Peter Borger
© 2021, http://www.genesisnet.info/schoepfung_evolution/n296.php
Zurück zur Artikel-Übersicht: https://www.wort-und-wissen.org/publikationen/genesisnet/
12.10.21 Fossile Mikroorganismen in sehr alten Sedimentschichten?
Die wohl größte Lücke im Fossilbericht befindet sich im Bereich der ältesten, d.h. der unten liegenden Sedimentschichten. Dort werden Mikroorganismen als frühe Lebensform vermutet. Daher gibt es seit einigen Jahrzehnten Bemühungen, fossile Hinweise auf Mikroorganismen zu finden. Kürzlich behauptete eine internationale Forschungsgruppe um Barbara Cavalazzi, die bisher ältesten fossilen Überreste von Archaeen gefunden zu haben. Die Arbeit verdeutlicht die Tendenz zur theoriegeleiteten Auswahl und Beurteilung von Daten zu mutmaßlich frühen Lebensformen.
Von der Schwierigkeit, Fossilien von Mikroorganismen zu finden
Fossilien dienen als Stützpunkte für die Rekonstruktion hypothetischer Verläufe der Naturgeschichte. Allerdings sind das Fehlen von Fossilien in einem großen Teil der geologischen Schichten sowie die offenen Fragen, wie vollständig und repräsentativ die gefundenen Fossilien für die entsprechenden Abschnitte der Vergangenheit sind, wiederholt als problematisch konstatiert worden. Mikroorganismen haben eine sehr geringe Aussicht, fossil überliefert zu werden. Besonders ausgeprägt ist der Mangel an Fossilien von Einzellern (Mikrofossilien). Um diese große Lücke im evolutionär gedachten frühen Bereich der Geschichte des Lebens, also im unteren Teil des Fossilberichts zu schließen, werden viele Bemühungen unternommen, Mikrofossilien zu finden.
Diese Suche ist jedoch besonders erschwert, da die Fossilisation von Einzellern im Vergleich zu vielzelligen Organismen, insbesondere solchen mit Hartteilen, bedeutend weniger wahrscheinlich ist. Ein weiteres Problem bei der Suche nach Spuren früher Mikroorganismen stellen Kontaminationen dar, die sowohl von heutigen Organismen als auch von den Forschern selbst stammen können (Gold et al. 2017); auch die Verwechslung mit anorganischen Strukturen ist eine Herausforderung. Außerdem sind Befunde, die als fossile Hinterlassenschaften von Bakterien oder Archaeen gewertet werden, wenig aussagekräftig bezüglich Eigenschaften wie Stoffwechsel oder molekulare Ausstattung. Befunde zu Mikrofossilien sind daher nicht selten umstritten.
Älteste fossile Rückstände von Mikroorganismen?
Eine internationale Forschergruppe um Barbara Cavalazzi (2021) präsentierte vor kurzem einige Funde und stellte sie als sichere und bisher älteste fossile Rückstände von Mikroorganismen dar. Wie viele andere Gruppen zuvor analysierten sie Gesteinsproben aus der in Südafrika gelegenen geologischen Schichtenfolge mit der Bezeichnung „Onverwacht-Gruppe“. Sie entnahmen magmatisches Quarzgestein aus der Kromberg-Formation aus ca. 7-8 km Tiefe und identifizierten in dessen feinen Kanälen Strukturen, die sie als fossile Rückstände von Archaeen deuteten. Nach allgemeiner Auffassung soll die geologische Schicht, aus der die Proben stammen, vor 3,4 Milliarden Jahren1 auf einer Flachmeer-Vulkan-Plattform entstanden sein. Mit der Zeit soll sich darin durch hydraulische Risserzeugung ein hydrothermales Kanalsystem2 herausgebildet haben.
Die Autoren interpretierten die Funde als fossile Rückstände von Mikroorganismen aufgrund von Analysen ihrer Form und der chemischen Bestandteile. Hinsichtlich der Form handelt es sich um unverzweigte Filamente (ø = 0,77 µm) mit einigen Unterbrechungen, was als typisches Erscheinungsbild fossilisierter mikrobiologischer Kulturen gilt. Die Unterbrechungen werden als Folge von Zellteilungen oder vor der Fossilisation stattfindendem Abbau der Zellen erklärt. Die gute Erhaltung der 3D-Struktur dieser Filamente wurde auf einen schnellen Versteinerungsvorgang zurückgeführt.
Durch Analyse der chemischen Bestandteile der Strukturen wurde Kohlenstoff als eine der Hauptkomponenten ermittelt, wobei auch die Elemente Wasserstoff, Sauerstoff und Stickstoff nachgewiesen werden konnten. Die Autoren schlossen daraus, dass es sich um Rückstände mineralisierter Zellwandbestandteile handelt. Überraschenderweise fehlte jedoch ein für alle Lebewesen essentielles und häufig vorkommendes Element: Phosphor.
Darüber hinaus wurden mittels Massenspektrometrie und Röntgenstrahlung Spuren von Schwefel und Nickel nachgewiesen. Durch weitere Analysen mittels Röntgenstrahlung wurden Rückschlüsse auf die Energie des K-Schalen-Niveaus des Nickels gezogen. Die Ergebnisse passten nach Auffassung der Autoren am besten zu Organonickel-Verbindungen mit Ni in den Valenzstufen II/III. Die Messung der Nickel-Konzentration in den Filamenten ergab ähnliche Werte, wie sie auch in heute vorkommenden methanerzeugenden Mikroorganismen vorgefunden werden.
Auf der Grundlage dieser Daten nehmen Cavalazzi et al. an, dass es sich bei den von ihnen untersuchten Strukturen um fossile Rückstände von methanerzeugenden Archaeen handelt. Das Hauptargument für die Zuschreibung des methanerzeugenden Stoffwechsels ist, dass heutige methanogene Archaeen Nickel-haltige Enzyme für diesen biochemischen Vorgang verwenden.
Zur Deutung der Funde
Insgesamt ist die Deutung der vorgefundenen Strukturen als fossile Rückstände von Mikroorganismen auf den ersten Blick plausibel, wobei die zeitliche Einordnung der Entstehung dieser Fossilien auf dem allgemein angenommenen Alter von 3,4 Milliarden Jahren der Kromberg-Formation beruht und ohne weiteres vorausgesetzt wird. Problematisch ist allerdings das komplette Fehlen des Phosphors in den Filamenten, da dieses Element in sehr vielen biologisch relevanten Molekülen vorhanden ist. Die Autoren kommentierten diesen problematischen Sachverhalt mit nur einem einzigen Satz: „Die Abwesenheit von P könnte das Ergebnis von Aufnahme [durch andere Organismen] oder Auswaschung dieses bioessentiellen Elements sein.“, Diese Ad-hoc-Erklärung leistet keinen Beitrag zu einem tieferen Verständnis des untersuchten Sachverhalts. Es ist überraschend, dass das im peer-review-Prozess des Journals Science offenbar nicht angemahnt worden ist. Es stellt sich automatisch die Frage, warum andere biologisch relevante Elemente wie Nickel oder Schwefel noch erhalten geblieben sind, während der Phosphor selektiv entfernt wurde.
Sollte es sich tatsächlich um fossile Reste von Mikroorganismen handeln, ist außerdem fraglich, ob sie tatsächlich von methanerzeugenden Archaeen stammen, da diese Schlussfolgerung ausschließlich auf den Daten bezüglich des Vorkommens von Nickel beruht. Da Nickel kein seltenes Element in der Erdkruste ist, rechtfertigt dessen Nachweis und Konzentration in den mineralisierten Strukturen allein nicht den Rückschluss auf einen methanogenen Stoffwechsel früher Organismen. Weitere Daten zur Stützung der These wären zwingend notwendig. Stattdessen berufen die Autoren sich wiederholt auf die allgemeine Annahme, dass methanogene Mikroorganismen zu den ältesten Lebensformen gehören. Zudem setzen sie wie viele andere Autoren völlig unkritisch voraus, dass die frühe Erdatmosphäre sauerstofffrei war – ungeachtet vieler Ungereimtheiten dieser Hypothese (Schmidtgall 2021).
In diesem Zusammenhang ist es auffällig, dass in einer Reihe von früheren Arbeiten zu Mikrofossilien über oxygene3 Photosynthese betreibende Organismen berichtet wurde, die bereits vor 3,1–3 ,4 Milliarden Jahren existiert haben sollen (Schopf 1993, Tice & Lowe 2004). Einige dieser Befunde wurden später aus fragwürdigen Gründen bestritten (Hohmann-Marriott & Blankenship 2011). Es wurde allgemein in Frage gestellt, ob der Fundort ungestört und für mikrobielles Leben geeignet sei. Solche Zweifel bei Mikrofossilfunden können aber prinzipiell immer angeführt werden können und sind daher nicht ausreichend, um eine ganze Reihe an Befunden in Frage zu stellen. Gegenwärtig finden Veröffentlichungen über oxygene Mikroorganismen vor 3,4 Milliarden Jahren kaum Beachtung und wurden auch von Cavalazzi et al. vernachlässigt. Interpretationen wie diejenige von Cavalazzi et al. ereilt dieses Schicksal dagegen vielleicht deshalb nicht, weil sie mit der Annahme einer frühen sauerstofffreien Atmosphäre zusammenpassen, die für die Evolutionstheorie unverzichtbar ist. Aufgrund von theoretischen Vorgaben wird hier offenbar bezüglich der Qualität der vorgebrachten Argumente mit unterschiedlichem Maß gemessen. Jedenfalls ist es überraschend, dass aus dem unspezifischen Vorkommen von geringen Mengen an Nickel weitreichende Schlussfolgerungen bezüglich des Stoffwechsels der vermuteten Mikroorganismen gemacht werden, während das komplette Fehlen des viel wichtigeren Phosphors, dessen Vorkommen in nennenswerter Konzentration zu erwarten wäre, praktisch ignoriert wird. Es liegt die Vermutung nahe, dass es für Cavalazzi et al. bei ihrer Dateninterpretation mehr auf die Kompatibilität der Ergebnisse zur Evolutionstheorie ankam als auf die tatsächliche Relevanz der Daten.
Anmerkungen
1 Die hier angeführten Altersdatierungen beruhen letztlich auf radiometrischen Datierungen. Daher sind Altersangaben i. S. v. radiometrischen Jahren und nicht tatsächlichen Jahren zu verstehen.2 Systeme, die heißes Wasser aus tiefen Schichten führen. Typische Beispiele hierfür sind Geysire. 3 Sauerstoff-erzeugende
Literatur
Cavalazzi B et al. (2021) Cellular remains in a 3,42-billion-year-old subseafloor hydrothermal environment. Sci. Adv. 7, eabf3963.
Gold DA et al. (2017) Paleoproterozoic sterol biosynthesis and the rise of oxygen. Nature 543, 420-423.
ohmann-Marriott MF & Blankenship RE (2011) Evolution of photosynthesis. Annu. Rev. Plant. Biol. 62, 515-548.
Schmidtgall B (2021) Die „Sauerstoffkatastrophe”, Stud. Integr. J. 28, 13-21.
Schopf JW (1993) Microfossils of the early archean apex chert: new evidence of the antiquity of life. Science 260, 640-646.
Tice MM & Lowe DR (2004) Photosynthetic microbial mats in the 3,416-Myr-old ocean. Nature 341, 549-552.
Autor dieser News: Boris Schmidtgall
© 2021, http://www.genesisnet.info/schoepfung_evolution/n295.php
Zurück zur Artikel-Übersicht: https://www.wort-und-wissen.org/publikationen/genesisnet/
29.07.21 Ganz oder gar nicht: Die sich teilende Zelle benötigt mindestens 492 Gene
Im Jahr 2010 berichteten die Medien, dass Forscher die erste lebende Zelle im Labor synthetisiert hätten. Tatsächlich hatten sie aber keine Zelle konstruiert, sondern das Erbgut eines Mycoplasma-Bakteriums synthetisch nachgebaut und in eine andere mikrobielle Zelle transplantiert. 2016 wurde das ursprüngliche Genom (= gesamtes Erbgut) mit einem Umfang von 1,08 Millionen Basenpaare (bp) auf 531.000 bp reduziert. Eine weitere Verkleinerung des Genoms war nicht möglich, da die Zelle sich dann nicht mehr teilen konnte und somit nicht mehr lebendig war. Im Jahr 2021 berichten dieselben Forscher, dass für eine korrekte Teilung mindestens 492 Gene erforderlich sind.
Manche Biowissenschaftler (Forscher im Bereich der Biologie) glauben, dass eine lebende Zelle hergestellt werden kann, wenn man nur die richtigen Biomoleküle zusammenbringt. Dieses sogenannte Bottom-up-Prinzip ist genau das, was J. Craig Venter sich vorgenommen hatte, um eine minimale Zelle herzustellen. Auch bekannt als genome warrior (Genom-Krieger) legte er als visionärer Biologe die Basis für eine sehr schnelle DNA-Sequenzierung. Er machte sich einen Namen, weil ihm die Entschlüsselung des menschlichen Genoms zu langsam voranging. Um hier schneller zum Ziel zu kommen, entwickelte eine neue revolutionäre Stategie, mit der man neue Gene sehr schnell sequenzieren konnte und nahm sein eigenes Genomprojekt mit seiner eigenen DNA in Angriff. Damit wollte er der Human Genome Organisation (HUGO), dem offiziellen internationalen Konsortium, das sich mit der Sequenzierung des menschlichen Genoms beschäftigte, um einiges voraus sein. Seine Anstrengungen wirkten tatsächlich wie ein Katalysator für das HUGO-Projekt. Drei Jahre vor dem erwarteten Abschluss des offiziellen Programms, im Jahr 2000, präsentierte Venter zusammen mit Francis Collins dem damaligen Direktor des HUGO-Projektes, die Kartierung des kompletten menschlichen Genoms.
Erbgut-Austausch in einer Mikrobe
Später, im Jahr 2010 synthetisierte (bzw. kopierte) Venter die aus 901 Genen bestehende DNA der Mikrobe Mycoplasma mycoides im Labor und brachte sie in die Hülle einer anderen nahe verwandten Mikrobe, Mycoplasma capricolum, ein (Gibson et al. 2010). Das synthetische Genom ersetzte dessen originale DNA und die so mit fremder DNA ausgestattete Mikrobe war erstaunlicherweise lebensfähig. Die DNA von M. mycoides wurde damit das neue Erbgut des Bakteriums (M. capricolum). Damit gelang ihm ein erstaunlicher Durchbruch innerhalb der synthetischen Biologie, denn er hatte das DNA-Molekül Buchstabe um Buchstabe, Segment um Segment, im Labor synthetisiert und unter Anwendung von biotechnischen Methoden zusammengefügt. Unbestritten lieferte sein Team mit der Synthese des bakteriellen DNA-Moleküls eine enorme Leistung ein, dennoch ist bei diesem Experiment nicht Leben erschaffen worden.
Wiewohl diese Angelegenheit in den Medien viel Aufsehen erregte – „Wissenschaftler schaffen künstliches Leben“ schrieben Journalisten – machte Venter grundsätzlich etwas Vergleichbares wie ein Autobastler, der in ein funktionsfähiges E-Mobil einen neuen Elektromotor einbaut, dessen Spule er selbst von Hand gewickelt hat und sich darüber freut, dass das modifizierte Automobil funktioniert. Genau genommen fertigte Venter überhaupt kein künstliches Leben an, sondern er transplantierte das synthetisch nachgebaute Erbgut einer Mikrobe in eine andere, sehr ähnliche Mikrobe. Eine verfahrenstechnisch imponierende Leistung, so aufsehenerregend wie die erste Herztransplantation.
Der nächste Schritt
Von seinem Erfolg beflügelt wollte Venter noch einen Schritt weitergehen. Er teilte sein Team in zwei Gruppen ein und beauftragte beide, unter Verwendung des gesamten verfügbaren biologischen Wissens und modernster Labortechnologie ein minimales DNA-Molekül zu entwerfen, das ein lebensfähiges Bakterium ermöglicht. Bald darauf wurden die beiden Entwürfe, die die Teams entwickelt hatten, im Labor synthetisiert, um dann die jeweils konstruierten Minimalgenome in Bakterien zu übertragen, denen zuvor die DNA entnommen worden war. Zu Venters Überraschung konnte keine der am Computer aufgrund molekularbiologischer Erkenntnisse entworfenen Genome das gesteckte Ziel erfüllen. Keine der beiden synthetischen Genomvarianten konnte die Zellen nach einer entsprechenden Transplantation funktionsfähig und lebendig erhalten. Venter selbst hielt unsere heutige Kenntnis bezüglich der Biologie für nicht ausreichend, um einen lebenden Organismus zu erschaffen. Ironischerweise war die Arbeit der Wissenschaftler, die das Genom von M. mycoides 2010 kopiert hatten, sehr prägend und die Forscher zitierten eine leicht gekürzte Version von Richard Feynmans Ausspruch: Was ich nicht schaffen kann, verstehe ich nicht. 2016 zeigte sich wie angemessen dieses Zitat war: Venters Teams hatte es nicht geschafft, ein lebensfähiges DNA-Molekül zu entwerfen. Sie verstanden tatsächlich selbst vergleichsweise einfache Lebewesen zu wenig, um den Entwurf des Lebens nachvollziehen zu können.
Nach der ernüchternden Erfahrung von Venter und seinem Team versuchten die Forscher – in der Hoffnung auf ein spektakuläres Resultat –, das synthetische Genom zu reduzieren, verfuhren also nach einer top-down-Strategie. Dazu verwendeten sie sie dieselbe Mycoplasma-Art mit ihren 901 Genen, mit der sie bereits experimentiert hatten (s. o.). Aus fragmentierten Genomen erzeugten sie kleinere Genome, die weniger Gene enthielten und testeten diese nach entsprechender Transplantation auf die Fähigkeit, unter Laborbedingungen fortpflanzungsfähige Zellen zu erhalten, d. h. die genetisch verarmten Bakterien wurden auf Vitalität getestet. Dabei entdeckten die Forscher, dass die minimale lebende Zelle – „lebend“ definiert als die Fähigkeit zur selbständigen Reproduktion – mindestens 473 Gene benötigt (Hutchinson 2016). Würde man noch irgendein beliebiges anderes einziges Gen löschen, verliert der Organismus das Vermögen der Zellteilung und ist leblos. Erstaunlicherweise ist bisher von 149 der benötigten Gene, also etwa einem Drittel, überhaupt nicht bekannt, welche Funktionen sie erfüllen – man weiß nur, dass sie unverzichtbar sind. Darunter gibt es sogar 79 Gene, die noch nie jemandem aufgefallen sind. Die Schlagzeilen im National Geographic berichteten: „Wir haben die einfachste Zelle der Welt gebaut – aber wir wissen nicht, wie sie funktioniert“ (Krulwich 2016).
Die Bedeutung von Venters Experimenten
Venters Experimente sind sehr bedeutsam für die Biologie und das Verständnis der Lebewesen, da sie darauf hinweisen, dass es Bakterien mit weiter reduziertem Genom sich nicht mehr reproduzieren können. Lebende Systeme, wie wir sie kennen, sogar die einfachsten Mikroben, können nur dank mehrerer Hundert Gene existieren – das sind mehr als eine halbe Million DNA-Buchstaben, die sehr genau aufeinander abgestimmt sein müssen. Hätte Venter die Mycoplasma-Gene nicht sehr exakt nachgebaut und diese dann genau nach dem natürlichen Vorbild miteinander verknüpft, hätten sich die transplantierten Zellen nicht vermehrt – und die Schlagzeilen in den Zeitungen wären ausgeblieben. Die transplantierte Mikrobe konnte sich teilen („sie lebte“) dank der in den Genen vorhandenen Information, die schon immer im Genom von Mycoplasma existierte.
Doch bei weiteren Untersuchungen der sich teilenden Minimalzelle stellten Venter und seine Kollegen fest, dass sie keine identischen Tochterzellen produzierten, wie es alle natürlichen Bakterien tun. Stattdessen produzierten sie Tochterzellen mit bizarren Formen und Größen. Nach weiteren fünf Jahren des Experimentierens stellen Pelletier et al. (2021) nun fest, dass die Minimalzelle 19 zusätzliche Gene benötigt, um sich korrekt teilen und ausgewogen wachsen zu können.
Mit somit insgesamt 492 Genen hat diese Minimalzelle 33 Gene weniger als der „Minus-Rekordhalter“ der Natur mit dem kleinsten Genom, Mycoplasma genitalium, das 525 Gene enthält. Die Mycoplasmen selbst sind aber parasitär lebende Endomikroben, die für ihre Existenz eine Wirtszelle benötigen. Sie verfügen nicht über genügend genetische Information, um selbständig und autark zu leben. Die einfachsten autonomen, frei lebenden Mikroben benötigen noch viel mehr Gene als die parasitären Mycoplasmen. Zurzeit hält Actinomarina minuta, eine Mikrobe der marinen Actinobakterien, den Minusrekord mit etwa 800 Genen (Ghai 2013). Die 492 Gene in Venters Minimal-Zelle – eine enorme Menge Information – sind essentiell: Fehlt nur ein einziges Gen, ist die Mikrobe lebensunfähig.
Venters Versuche zeigen, dass lebende, sich reproduzierende Organismen nicht auf einzelne Gene zurückzuführen sind und dass lebende Organismen genetisch nicht beliebig reduzierbare holistische Informationssysteme beinhalten. Wie eine schrittweise Entwicklung verlaufen sollte, bei der ein Gen nach dem anderen entsteht, ist nach bisherigen Erkenntnissen vollkommen unklar. Ein einziges Gen hat für sich alleine keine Funktion. Zwei oder drei Gene bringen ebenso nichts. Sogar 300 Gene sind noch immer wirkungslos. Erst 492 Gene, etwa eine halbe Million DNA-Buchstaben in der richtigen Reihenfolge, ermöglicht einen sich selbst reproduzierenden Organismus (unter Labor-, d. h. optimierten Lebensbedingungen). Nur ein Gen weniger und es gibt keine DNA-Verdopplungen; und wenn es nicht zu DNA-Verdopplungen kommt, kommt es ebenfalls nicht zu Mutationen. Ohne Venters 492 Gene gebe es für die natürliche Auslese keine Arbeit, keine Weiterentwicklung, keine neuen Organismen.
Reproduzierende Organismen sind die wichtigste Voraussetzung für einen evolutiven Vorgang gemäß Darwins Theorie. Die Weiterentwicklung des Lebens kann erst mit einem Minimum von 492 Genen anfangen. Eine lebendige Zelle ist ein holistisches System!
Venter selbst kommentierte: „Vielleicht ist das Leben nicht aus unabhängigen Teilen aufgebaut, so wie man eine Maschine in einer Werkstatt aufbaut. Vielleicht kann man nicht einen Haufen bekannter Gene nehmen, sie zusammenklemmen, wobei jedes sein eigenes Ding macht, und dann, wenn man die letzte Schraube anzieht, entsteht plötzlich – Tadaaa – ein neues Lebewesen. Anstatt sich auf die Gene zu konzentrieren, sollten wir vielleicht das ganze Betriebssystem betrachten – nicht die Gene, sondern das ‚Genom‘, ein funktionierendes Ganzes“ (Krulwich 2016). Dabei lebt ja auch ein komplettes Genom nicht, wenn es nicht in einer genau darauf abgestimmten komplexen Zelle steckt, denn nach wie vor ist eine Zelle die kleinste uns bekannte Einheit, die das Phänomen „Leben“ zeigt.
Literatur
Krulwich B (2016) We built the world’s simplest cell – but dunno how it works. https://www.nationalgeographic.com/science/article/we-built-the-worlds-simplest-cell-but-dunno-how-it-works
Ghai R et al. (2013) Metagenomics uncovers a new group of low GC and ultra-small marine Actinobacteria. Sci Rep 3:2471, doi: 10.1038/srep02471.
Gibson DG et al. (2010) Creation of a bacterial cell controlled by a chemically synthesized genome. Science 329, 52-56.
Hutchinson III CA, et al. (2016) Design and synthesis of a minimal bacterial genome. Science 351, aad6253; doi: 10.1126/science.aad6253
Pelletier JF et al. (2021) Genetic requirements for cell division in a genomically minimal cell. Cell 184, 2430-2440.
Autor dieser News: Peter Borger
© 2021, http://www.genesisnet.info/schoepfung_evolution/n293.php
Zurück zur Artikel-Übersicht: https://www.wort-und-wissen.org/publikationen/genesisnet/
19.02.21 Leben auf der Venus – doch nur eine leere Sensationsmeldung?
Gelegentliche Meldungen, es gäbe gute Hinweise auf außerirdisches Leben. werden medial euphorisch verbreitet. Im vergangenen Herbst wurde behauptet, es könnte Leben auf der Venus geben, obwohl der Planet aufgrund seiner extremen Atmosphärenbedingungen wohl kaum als habitabel (= lebenstauglich) gelten könnte. Interessanterweise musste die wissenschaftliche Gruppe, auf die diese Meldung zurückgeht, vor Kurzem die Interpretation ihrer Befunde deutlich korrigieren – ein mediales Echo blieb hier jedoch aus.

Abb. 1: Darstellung der Venus. (Wikimedia: NASA/JPL – http://photojournal.jpl.nasa.gov/catalog/PIA00104, Public Domain)
Der Nachweis von Lebewesen auf einem anderen Planeten – das wäre nicht nur eine Sensation, sondern auch eine Bestätigung der Erwartung vieler Astrobiologen. Ausgehend von der evolutionstheoretischen Annahme, dass Leben durch bloße physikalisch-chemische Vorgänge entstehen kann, äußerte Cairns-Smith vor etwa vierzig Jahren folgende Annahme: „Andere, möglicherweise einfachere und bessere [Lebens]systeme könnten irgendwo anders evolviert sein.“ Andere Forscher wie etwa Steven Benner bemühten sich darum, vorherzusagen, welche molekularen Spuren von außerirdischem Leben künftig gefunden werden könnten (Benner 2002). In einigen Veröffentlichungen und auf Konferenzen wurde darüber spekuliert, wie die Biochemie von Aliens aussehen könnte. Kurzum, die Erwartungshaltung, Leben auf anderen Planeten zu finden, ist ausgehend von evolutionstheoretischen Überlegungen hoch. Daher ist es nicht überraschend, dass selbst unsichere Hinweise auf Lebewesen auf anderen Planeten sehr euphorisch aufgenommen und eilig verbreitet werden. So wurde im vergangenen Jahr gemeldet, eine Forschergruppe habe Proteine in einem Meteoriten nachgewiesen (McGeoch et al. 2020; Crane 2020). Bei näherer Betrachtung erwies sich der Befund jedoch als pure Spekulation auf einer äußerst dünnen Datenbasis (Schmidtgall 2020).
Deutlich mehr Aufsehen erregte eine andere Meldung: Im September vergangenen Jahres wurde in vielen Zeitungen, Onlineportalen und Nachrichtensendungen überraschend behauptet, es gäbe möglicherweise Leben auf der Venus. Schlagzeilen wie „Hinweise auf Leben in der Venus-Atmosphäre versetzen Forschern einen ‚Schock‘“ (stern.de) waren keine Seltenheit. In einem ZDF-Video vom 14. 9. 2020 sagt die deutsche Astrophysikerin Dr. Suzanna Randall sogar: „Auf der Venus könnte es über 3 Milliarden Jahre lebensfreundliche Bedingungen gegeben haben.“ Und weiter: „Die Hinweise auf Leben in der venusischen Atmosphäre verdichten sich. […] Aber das Monophosphan gibt den Ausschlag: Es könnte durchaus Leben auf der Venus geben.“
Das von Randall erwähnte Monophosphan (auch Phosphin genannt) ist eine chemische Verbindung, die dafür bekannt ist, dass sie auf der Erde entweder von Chemikern im Labor oder von Mikroorganismen erzeugt wird. Hingegen konnte die Entstehung von Phosphin bisher nicht durch geologische Ursachen erklärt werden, weswegen es als „Biosignaturgas“ bezeichnet wird – als Hinweis auf das Vorhandensein von Lebewesen. Nun behauptete im September 2020 eine Gruppe von Wissenschaftlern um Jane S. Greaves, Hinweise auf das für Menschen giftige Gas in der Venusatmosphäre erhalten zu haben. Sie beschrieben in einem Artikel in Nature Astronomy ein angeblich für Phosphin typisches, langwelliges Absorptionssignal, das mithilfe zweier hochempfindlicher Radioteleskope detektiert worden sei. Da es als gesichert gilt, dass Phosphin in der Venusatmosphäre relativ schnell durch oxidative Vorgänge (Reaktionen mit Sauerstoff) abgebaut würde, stellte sich unmittelbar die Frage nach der Quelle des Gases. Im Unterschied zu den Massenmedien waren die Wissenschaftler jedoch in ihrer Schlussfolgerung weit vorsichtiger: „Auch wenn es sich bestätigt hat, betonen wir, dass der Nachweis von PH3 (Phosphin) kein zuverlässiger Hinweis auf Leben ist, sondern auf eine ungewöhnliche und unerklärte Chemie“ (Greaves 2020a). Ungeachtet solcher mahnender Sätze löste die Publikation viele Spekulationen darüber aus, wie das Phosphin auf der heißen und von Schwefelsäure-Wolken umgebenen Venus entstanden sein könnte: Es wurden unter Berufung auf frühere hypothetische Überlegungen (Sousa-Silva 2020) Vermutungen angestellt, dass in einer Höhe von 40-60 km eine „habitable Zone“ existieren könnte, in der eventuell Mikroorganismen leben könnten, die Phosphin erzeugen.
Doch so sensationell die Meldung von „möglichen Hinweisen auf Leben“ auf der Venus auch war, sie musste vor kurzem erheblich abgeschwächt werden. Zunächst übten andere Wissenschaftler scharfe Kritik an den Befunden von Greaves et al. Eine kritische Betrachtung der Befunde wurde von Villanueva et al. in Form eines Vorabdrucks veröffentlicht. Darin wurde in Frage gestellt, dass das Absorptionssignal von Phosphin sauber detektiert werden könne, da das sehr häufig auf der Venus vorkommende Schwefeldioxid ein sehr ähnliches Signal erzeugt. Die beiden Rotationsübergänge (spektralen Signaturen) lägen so nah beieinander (Phosphin PH3 (J=1-0): 266.944513 GHz, Schwefeldioxid SO2 (J = 309,21-318,24): 266.943329 GHz), dass eine spektroskopische Trennung der beiden Signale nicht möglich sei. Des Weiteren wurde angeführt, dass Abweichungen in der Form der spektroskopisch beobachteten Linien zu groß seien, als dass eine sichere Unterscheidung der beiden Gase anhand der Detektionsmethoden möglich sei. Kritik wurde auch von einer Forschergruppe um Therese Encrenaz geäußert, die schon im Jahr 2015 versucht hatte, Phosphin in der Venusatmosphäre nachzuweisen. Die Forscher bezweifelten ebenfalls, dass die Befunde von Greaves et al. einen sicheren Nachweis von Phosphin in der Venusatmosphäre bedeuten: „Jedenfalls bräuchte es unbedingt mindestens einen weiteren PH3-Übergang (d. h. ein weiteres Absorptionssignal) im Infrarot- oder Millimeter/Submilimeter-Bereich, um die Detektion von PH3 auf der Venus zu bestätigen.“
Kaum einem Menschen fällt es leicht, früher sicher vorgetragene Behauptungen zu entkräften oder sogar zurückzunehmen. Gerade Wissenschaftler neigen dazu, eigene Theorien mit großem Eifer zu verteidigen, selbst wenn die Indizienlage schlecht ist. Im Fall des angeblichen Phosphin-Nachweises war die Kritik verschiedener Experten jedoch so überwältigend, dass eine erneute Überprüfung der Befunde durch Greaves et al. unumgänglich war. Nun mussten sie jedoch in einer neueren Veröffentlichung zugeben, dass das Phosphin-Signal deutlich schwächer ist als zuvor angenommen (Greaves et al. 2020b). Sie schätzten die Phosphin-Konzentration nunmehr um den Faktor sieben kleiner ein als bei der ersten, euphorisch aufgenommenen Publikation. Ferner gestanden sie ein, dass es Fehler bei der Datenverarbeitung und -Interpretation gab und bezeichneten ihre Entdeckung von Phosphin in der Venus-Atmosphäre anderslautend als zuvor als „vorläufig“.
Insgesamt wird also deutlich, dass die Schlussfolgerung, es gäbe ein „Biosignaturgas“ in der Venusatmosphäre und damit Hinweise auf irgendeine außerirdische Lebensform, eher spekulativen Charakters sind. Es ist jedoch bezeichnend, dass die Richtigstellung der sensationellen Meldung kein nennenswertes Echo in den Massenmedien auslöste. Meldungen, die Zweifel an evolutionstheoretischen Erwartungen auslösen, sind nun einmal unbeliebt.
Literatur
Cairns-Smith AG (1975) A case for an alien ancestry, Proc. R. Soc. Lond. B 189, 249-247.
Encrenaz T et al. (2020) A stringent upper limit of the PH3 abundance at the cloud top of Venus, Astronomy & Astrophysics 643, L5.
Greaves JS et al. (2020) a. Phosphine gas in the cloud decks of Venus. Nature Astronomy, https://doi.org/10.1038/s41550-020-1174-4; b. Re-analysis of Phosphine in Venus’ Clouds. arXiv:2011.08176.
McGeoch MW et al. (2020) Hemolithin: a Meteoritic Protein containing Iron and Lithium,
arXiv:2002.11688
Crane L. (2020) Have we really found an alien protein inside a meteorite? Newscientist, https://www.newscientist.com/article/2235981-have-we-really-found-an-alien-protein-inside-a-meteorite/#ixzz6IZ0PeUUV
Schmidtgall B (2020) Proteine in Meteoriten – heiße Spur außerirdischer Lebewesen? Studium Integrale Journal 27, 129-130.
Sousa-Silva C et al. (2020) Phosphine as a Biosignature Gas in Exoplanet Atmospheres. Astrobiology 20, 235-268.
Autor dieser News: Boris Schmidtgall
© 2021, http://www.genesisnet.info/schoepfung_evolution/n287.php
Zurück zur Artikel-Übersicht: https://www.wort-und-wissen.org/publikationen/genesisnet/
03.04.20 Was sind Viren und woher stammen sie?
Seit dem Ausbruch des RNA-Virus SARS-CoV2 (COVID-19), das eine gefährliche Lungenkrankheit auslösen kann, gibt es Interesse an grundsätzlichen Fragen zu Viren. Was sind Viren? Wo haben sie ihren Ursprung? Werden sie sich weiter verändern? Besteht unser Erbgut wirklich zu einem großen Teil aus eingefangenen Viren, wie von Evolutionsbiologen oft behauptet wird? Woher kommen die Reversen Transkriptasen? Diese Fragen waren bis vor kurzem sehr schwer zu beantworten, sowohl in einem Schöpfungsrahmen als auch in einem Evolutionsrahmen. Seit etwa einem Jahrzehnt haben wir ein viel besseres Verständnis.
Viren sind Molekularparasiten. Viren sind nicht selbständig lebensfähig. Sie können sich nur vermehren, indem sie das Genom (= Erbgut) einer Wirtszelle „hacken“. Sie injizieren ihr Informationsmolekül (DNA oder RNA) in die Wirtszelle und nutzen so deren genetische Maschinerie, um Kopien ihres eigenen Erbguts herzustellen und sich unter Ausnutzung des Translationsapparats* zu vervielfältigen. Manchmal zerstören sie die Wirtszelle. Viren könnten nach evolutionären Vorstellungen einfache Vorformen erster Lebewesen sein [1]. Obwohl diese Sichtweise nicht von allen Wissenschaftlern geteilt wird, ist es diejenige, die in Zeitungen und Zeitschriften popularisiert wird [2]. Da Viren aber ohne ihre Wirte nicht existieren können, d.h. nicht vermehrungsfähig sind und daher als molekulare Parasiten angesehen werden müssen, können sie nicht zuerst existiert haben, sondern müssen nach ihren Wirten entstanden sein.
*Translationsapparat (= molekulare Maschinen, die DNA über mRNA in Proteine übersetzen)
In den letzten 10-20 Jahren wurden immer mehr Viren entdeckt. Heute sind mehrere tausend verschiedene Viren identifiziert. Fast alle sind für den Menschen harmlos. Wir verstehen erst seit kurzem, dass das Virom (die Gesamtheit der Bakteriophagen und Viren in einem Organismus) eine wichtige Rolle bei der Regulierung der Anzahl und Arten von Bakterien in Organismen spielen [3]. Viren, die Bakterien nutzen, werden Bakteriophagen genannt; es gibt im Darmtrakt davon mehr als Bakterien. Es hat sich herausgestellt, dass Viren die Anzahl der Mikroben kontrollieren. Jedes Bakterium hat sogar seinen eigenen spezifischen Bakteriophagen! Wäre das nicht der Fall, gäbe es zu viel von einer Bakterienart, und das wäre für den Wirtsorganismus schädlich bis katastrophal. Auf dieser Ebene sind Viren also eine Art Regulierungssystem. Alles in der Biologie wird kontrolliert und reguliert. Manchmal auf eine Art und Weise, die wir überhaupt nicht erwartet hatten oder noch nicht verstehen. Aus der Sicht der Schöpfung ist anzunehmen, dass solche Viren als Regulatoren Bestandteil der Schöpfung sind, um die Anzahl der Mikroorganismen im Gleichgewicht zu halten. Ein Argument für diese Einschätzung ist die erwähnte Tatsache, dass die meisten bekannten Viren für Pflanzen, Tiere und den Menschen harmlos sind.
Doch gibt es auch gute Gründe für die Sichtweise, dass nicht alle Viren erschaffen worden sind. Denn bekanntlich sind nicht alle harmlos. Einige sind erst vor kurzem entstanden, wie die RNA-Viren in Eukaryonten* – insbesondere die in Säugetieren und Menschen.
*Eukaryonten (= Lebewesen, die aus Zellen mit Zellkern bestehen)
Die Viren können in verschiedene Gruppierungen eingeteilt werden. So spricht man von DNA-Viren und RNA-Viren, deren Erbgut in Form von DNA bzw. RNA in den Viruspartikeln enthalten ist. Daneben kennt man Makroviren und Mikroviren. Mikroviren können entweder DNA- oder RNA-Viren sein. Makroviren sind immer DNA-Viren und lassen sich oft auf degenerierte Mikroorganismen zurückführen, wie z. B. das DNA-Virus „Mimivirus“. Dieses hat ein Genom, das fast so groß ist wie das eines Bakteriums, und weitere Analysen ergaben, dass solche Viren wahrscheinlich von harmlosen Bodenbakterien abstammen [4]. Durch den Einbau einiger viraler Gene, die für die Hülle kodieren, sieht es wie ein riesiges Virus aus.1 Und da es enorm degeneriert ist, kann es nur noch als Parasit in einer Wirtszelle existieren und ist wie alle Viren nicht selbständig lebensfähig (s. o.). Inzwischen sind Dutzende solcher degenerierter Makroviren entdeckt worden. Einige der Makroviren enthalten mehr DNA als vom Genom der kleinsten Bakterien bekannt ist.
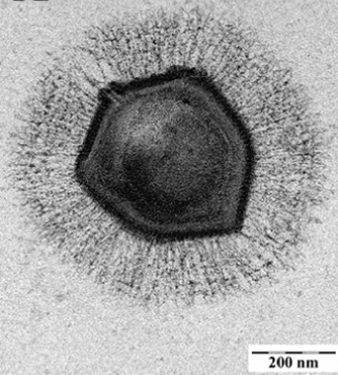
Abb. 1: EM-Aufnahme eines Virions der Gattung Mimivirus. (Wikimedia: Ghigo E, Kartenbeck J, Lien P, Pelkmans L, Capo C, Mege JL, Raoult D. – http://www.plospathogens.org/article/info%3Adoi%2F10.1371%2Fjournal.ppat.1000087PLoS Pathog. 2008 Jun 13;4(6):e1000087. doi: 10.1371/journal.ppat.1000087, CC BY 2.5)
Winzige RNA-Viren. Diese viel kleineren RNA-Viren haben nur wenige Gene (normalerweise nicht mehr als ein Dutzend), sind aber oft sehr gefährlich für den Menschen. Das Coronavirus COVID-19 (SARS-CoV2) ist ein solches RNA-Virus. Andere bekannte Beispiele sind das Grippevirus (Influenza-Virus) und HIV (das AIDS verursacht). Der Ursprung dieser Viren liegt noch nicht lange zurück. Woher stammen sie? Sehr wahrscheinlich haben sie ihren Ursprung im Genom von Wirbeltieren. Sie entstehen hier aus genetischen Elementen, die fast genauso ausgestattet sind wie echte RNA-Viren: Endogene Retroviren (ERV). ERV machen etwa 8% des menschlichen Genoms aus. Manchmal verläuft die Umlagerung der ERV (oder: „gag-pol-Elemente“) fehlerhaft. Dadurch können RNA-Viren entstehen. Ein Beispiel ist ein RNA-Virus der Vögel, das Rous Sarcoma Virus (RSV) [5]. Dieses Virus verursacht eine Form von Krebs. Bei genauerem Hinsehen entpuppt sich das RSV-Virus als ein ERV, das dem Wirtsgenom ein kleines Stück zusätzliches genetisches Material entnommen hat. Dieses kleine zusätzliche Stück genetischen Materials ist eine Domäne (= Abschnitt) eines Proteins (SRC genannt), das ungebremst die Zellteilung ankurbelt. Und so entsteht in einem Schritt ein Onco-Virus, das Krebs auslöst. Während meiner Forschung an mehreren Universitäten habe ich versucht, ein besseres Verständnis der sogenannten endogenen Retroviren zu bekommen. Ich bin zu der Schlussfolgerung gekommen, dass sie keine Überbleibsel der RNA-Viren sind, sondern ein funktioneller Teil des Genoms. Meiner Meinung nach ist die gängige Meinung, dass die Genome von Tieren und auch das Genom des Menschen aus den Überresten von uralten RNA-Viren aufgebaut sind, falsch. Höchstwahrscheinlich ist es umgekehrt: RNA-Viren sind entgleiste „gag-pol-Elemente“ (normalerweise ERV genannt), biologische Werkzeuge, die mehrere wichtige biologische (Transport)-Funktionen erfüllen [6-8].2
Was spricht dafür, dass die gängige Meinung über die Entstehung von RNA-Viren falsch ist? Ein starkes Argument ist das RNA-Virus-Paradoxon. Es besagt, dass nach der molekulargenetischen Phylogenie der RNA-Viren alle diese Viren, einschließlich der oben erwähnten ERV, nicht älter als etwa 50.000 Jahre alt sein können [9]. Zudem gibt es die Beobachtung, dass Viren sich in ihrer Wirkung im Laufe der Zeit immer mehr abschwächen durch genetische Entropie (Verlust von nutzbarer Information) und nicht gefährlicher werden [10]. Darüber hinaus zeigen die Details in der Genetik von genauer bekannten RNA-Viren oft, dass ihr natürlicher Ursprung rekonstruiert und zurückverfolgt werden kann. Und dies führt ihren Ursprung zurück ins Genom der heutigen Wirte. Beispielsweise kann das oben erwähnte RSV auf ein ERV plus einen Teil des SRC-Gens (ein Proto-Onco-Gen) im Genom des Vogels zurückverfolgt werden. Es integrierte nur den On-Switch des Gens und so verwandelte es in ein Onco-Virus. Ebenso beobachteten wir eine kleine (menschenähnliche) IL8-Sequenz beim HIV (RNA-Virus, das AIDS verursacht), die zum Eindringen in die menschlichen Immunzellen verwendet wird. Und das RNA-Virus, das Influenza (Grippe) verursacht, hat einen Teil des (menschenähnlichen) Neuramidase-Gens integriert. RNA-Viren haben also sehr wahrscheinlich ihren Ursprung im Genom komplexerer Organismen, und zwar in ERV. Man kann die ERV mit einem von Menschen gemachten selbstfahrenden Automobil vergleichen. Aufgrund eines Programmierfehlers kann es einen Menschen überfahren und töten. Wenn keine Maßnahmen ergriffen werden, um das Auto aus dem Verkehr zu ziehen, kann es immer wieder töten. Allerdings wurde das Auto sicherlich nicht mit der Absicht des Tötens hergestellt. Bei ERV ist das genau so. Sie können zu RNA-Viren werden, sind aber nicht so ursprünglich entworfen worden.
Es wird behauptet, dass manche RNA-Viren ein Enzym enthalten, das nur in RNA-Viren existiert: die Reverse Transkriptase (RT). Dieses Enzym wird dazu verwendet, das einzelsträngige RNA-Molekül in DNA zu übersetzen, damit es sich in das Wirtsgenom integrieren kann. Bei allen RNA-Viren wird die RT durch das so genannte „pol“-Gen kodiert. Es codiert für ein Polyprotein, das in vier Enzyme gespalten wird: Protease (die die Spaltung vornimmt3, RNase, Integrase und RT. Interessanterweise findet man das „pol“-Gen nicht nur bei RNA-Viren, sondern auch in allen ERV („gag-pol- Elemente“). Dies ist der Grund, warum viele Evolutionsbiologen davon ausgehen, dass ERV die Überreste alter RNA-Virus-Invasionen ins Erbgut von Wirtsorganismen sind. Dennoch gibt es in den Genomen der höheren Lebewesen mehrere RT-Enzyme, die in allen Genomen vorkommen. Es gibt Hunderttausende von RT-Genen im Genom, und zwar in ERV, die sehr ähnlich dem der RNA-Viren sind. Es gibt auch Hunderttausende von RT-Genen in LINEs (Long Interspersed Nucleotide Elements), transposonähnliche genetische Elemente (= „springende Gene“), die die Genexpression (= Ablesung von Genen) und Zelldifferenzierung kontrollieren [6, 11]. Die in LINEs gefundenen RT unterscheiden sich von denen von ERV. Und es gibt TERT, ein RT, dass zur Verlängerung der Telomere (= Endstücke der Chromosomen) benötigt wird [12]. Es gibt also drei unterschiedliche RT-Enzyme im Genom. Die Behauptung, das Vorkommen von RT sei spezifisch für RNA-Viren, ist also falsch. RT-Gene werden überall im Genom der höheren Lebewesen vorgefunden; das ist ein weiteres starkes Argument dafür, dass RNA-Viren ihren Ursprung im Genom haben. RNA-Viren sind also nicht die Schöpfer des Genoms, wie man heutzutage oft behauptet, sondern Degenerationsprodukte des geschaffenen Genoms.
Quellen
[1] Villarreal LP (2005) Viruses and the Evolution of Life. Washington, DC: ASM Press, xv, 395 pp. http://www.loc.gov/catdir/toc/ecip0419/2004013977.html
[2] Aktuelles Beispiel: https://www.tagesspiegel.de/wissen/ursprung-des-lebens-am-anfang-war-das-virus/11867530.html
[3] Francis JW, Ingle M & Wood TC (2018) Bacteriophages as beneficial regulators of the mammalian Microbiome. Proc. Int. Conf. Creationism 8, 152–157.
[4] Raoult D et al. (2004) The 1.2-megabase genome sequence of Mimivirus. Science 306, 1344–1350.
[5] Terborg P (2009) The design of life: part 3 – an introduction to variation-inducing genetic elements. J. Creation 23, 99-106.
[6] Terborg P (2018) ERVs and LINEs – along novel lines of thinking. J. Creation 32, 8–11.
[7] Pastuzyn ED et al. (2018) The neuronal gene ARC encodes a repurposed retrotransposon gag protein that mediates intercellular RNA transfer. Cell 172, 275–288.
[8] Ashley J et al. (2018) Retrovirus-like gag protein ARC1 binds RNA and traffics across synaptic boutons. Cell 172, 262–274.
[9] Holmes EC (2003) Molecular clocks and the puzzle of RNA virus origins. J. Virology 77, 3893–3897.
[10] Carter RW & Sanford JC (2012) A new look at an old virus: patterns of mutation accumulation in the human H1N1 influenza virus since 1918. Theor. Biol. Med. Model. 9:42; doi: 10.1186/1742-4682-9-42.
[11] Jachowicz JW et al. (2017) LINE-1 activation after fertilization regulates global chromatin accessibility in the early mouse embryo. Nature Genetics 49, 1502–1510.
[12] Sui X, Kong N, Wang Z & Pan H (2013) Epigenetic regulation of the human telomerase reverse transciptase gene: A potential therapeutic target for the treatment of leukemia (Review). Oncol. Lett. 6, 317–322. Epub 2013 May 29.
Anmerkungen
1 Die viralen Gene, aus denen die Hülle besteht, stammen wahrscheinlich von einem Virus, das sich in das Genom des Bakteriums integriert hat.
2 Zu diesem Thema ist ein Artikel für die Herbstausgabe 2020 von Studium Integrale Journal geplant.
3 Die pol-RNA wird sofort abgeschrieben und dadurch entsteht zuerst die Protease, die die andere Enzyme spaltet. Das Gen codiert für vier Proteine.
Autor dieser News: Peter Borger
© 2020, http://www.genesisnet.info/schoepfung_evolution/n278.php
Zurück zur Artikel-Übersicht: https://www.wort-und-wissen.org/publikationen/genesisnet/
29.07.19 DNA als Retter der RNA-Welt-Hypothese?
Ungeachtet ihrer Beliebtheit weist die RNA-Welt-Hypothese als Erklärung des Ursprungs der ersten Organismen große Defizite auf. Im Sinne einer Ergänzung dieser Hypothese veröffentlichte die Forschungsgruppe um Oliver Trapp eine Arbeit zur präbiotischen Synthese von Desoxy-Nukleosiden (DNA-Bausteine). Diese Arbeit wurde auf der populärwissenschaftlichen Seite scinexx recht euphorisch kommentiert und als Erklärung für den natürlichen Ursprung der DNA vorgestellt. Eine genauere Analyse zeigt jedoch, dass sich ein gänzlich anderes Bild ergibt.
Nach Ansicht der meisten Lebensursprungs-Forscher stellten sich selbst vervielfältigende molekulare Systeme auf der Basis von RNA-Molekülen das Vorstadium zu den ersten Organismen dar. Die RNA gilt als der beste Kandidat für einen möglichst einfachen Ursprung des Lebens, weil sie als einziges Biomolekül zugleich zwei wichtige Eigenschaften in sich vereint: sowohl die Fähigkeit zur Informationsspeicherung und -übertragung als auch zur Katalyse (Beschleunigung) bestimmter chemischer Reaktionen. Damit wären zumindest hypothetisch chemische Verbindungen in einer „RNA-Welt“ vorhanden, die sowohl Stoffwechsel als auch Vererbung ermöglichen (Gilbert 1986).
Allerdings sind gravierende Schwächen des RNA-Welt-Modells in der Fachwelt allgemein bekannt. Weder für die Möglichkeit der Entstehung der notwendigen Bausteine der RNA, der Ribonukleotide, noch für ihre anschließende Polymerisation (Verknüpfung) zu RNA-Strängen sind plausible präbiotische Bedingungen aufgezeigt worden. Noch weit größer ist die Herausforderung, die anschließend erforderliche Replikation (Vermehrung) der RNA in einem wässrigen, annähernd natürlichen Milieu zu realisieren. Das Kernproblem dabei ist die ausgeprägte Labilität sowohl der RNA-Bausteine als auch des Makromoleküls RNA selbst in wässriger Lösung. Behauptungen, dass diese Probleme schon gelöst seien, sind nicht überzeugend, denn die Publikationen, auf die dabei oft verwiesen wird (Powner 2009, Ferris 2006, Deck 2011), beschreiben Kunstgriffe, die auf chemischer Erfahrung beruhen und die keinerlei Bezug zu realistischen Bedingungen auf einer Erde haben. Diese offenkundigen Schwächen des RNA-Welt-Modells veranlassen Forscher immer wieder dazu, das bestehende Modelle abzuwandeln oder neue Ideen für einen hypothetischen Anfang des Lebens zu entwickeln. Kritische Kommentare dazu wurden bereits früher publiziert (Binder 2009, Schmidtgall 2014).
Eine Möglichkeit, die bereits früher erwogen worden ist, besteht in der stabilisierenden Wirkung des chemisch verwandten Biopolymers der RNA, der DNA (Lindahl 1993). Allerdings galt ihre Entstehung bisher als problematisch, weil nach den gängigen Vorstellungen DNA aus RNA gebildet worden sein soll und dazu das komplexe Enzym Ribonukleotid-Reduktase erforderlich ist. Dieses entfernt die Hydroxy-Gruppe an der 2‘-Position der Ribose und wandelt sie in 2-Desoxyribose um (s. Abb. 1). Das wäre aber kein einfacher Anfang des Lebens.
Abb. 1: Strukturformeln der Bausteine der RNA (Ribonukleotide) und der DNA (Desoxy-Ribonukleotide). Die zwei strukturellen Unterschiede zwischen den Bausteinen sind die fehlende OH-Gruppe an der 2‘-Position bei den DNA-Bausteinen und das Thymin anstelle des Uracil als eine der kanonischen Nukleobasen. Damit also Desoxy-Ribonukleotide hergestellt werden können, muss die 2‘-OH Gruppe der Ribonukleotide entfernt werden. In Organismen ist dafür das Enzym Ribonukleotid-Reduktase zuständig.
Überraschenderweise wurde kürzlich in einem Artikel auf der populärwissenschaftlichen Internetseite scinexx berichtet, dass es einer Forschergruppe an der LMU München gelungen sei zu zeigen, wie DNA ohne Beteiligung von Enzymen unter natürlichen Bedingungen entstanden sein kann. Träfe diese Behauptung zu, hätten wir es mit einem gewaltigen Fortschritt in der Lebensursprungsforschung zu tun. Der „Alptraum der Präbiotiker“ – eine Bezeichnung der RNA, die von S. A. Benner stammt (Benner 2013) – hätte möglicherweise bald ein Ende. Denn wenn DNA unter natürlichen Bedingungen ohne Enzyme gebildet werden kann, dann ist es naheliegend, dass das auch für RNA möglich ist.
Die scinexx-Autorin bezog sich in ihren Ausführungen auf einen kürzlich in der chemischen Fachzeitschrift Angewandte Chemie erschienenen Artikel der Forschungsgruppe um Oliver Trapp (Teichert et al. 2019). In diesem Artikel ist allerdings an keiner Stelle die Rede davon, dass tatsächlich DNA entstanden sei. Die Autoren der Originalarbeit befassten sich ausschließlich mit der Entstehung von DNA-Nukleosiden – das heißt den Einzelbausteinen der Erbsubstanz – durch Reaktion dreier chemischer Verbindungen (Nukleobasen, Acetaldehyd und D-Glyceraldehyd, vgl. Abb. 2). Dass sich die Einzelbausteine anschließend zur DNA zusammenzufügen, ist aber alles andere als selbstverständlich. Man könnte geneigt sein, der scinexx-Autorin einen Schreibfehler zu unterstellen, wenn im Rest des Artikels eine auch nur ansatzweise kritische Reflektion der Originalarbeit erkennbar wäre. Dies ist allerdings nirgendwo der Fall.
Abb. 2: In der Arbeit von Trapp et al. untersuchter Reaktionsweg ausgehend von Nukleobasen, Acetaldehyd und D-Glyceraldehyd. Hier ist der Reaktionsweg exemplarisch am Adenin gezeigt. Die Reaktion ergibt aber ebenso auch Desoxy-Nukleotide bei Verwendung der anderen drei Nukleobasen. Die Ausbeuten der Reaktionen waren mit unter einem Prozent (Adenosin, Guanosin, Thymidin) bzw. 2,5% für Cytidin recht niedrig.
Weiter heißt es in dem scinexx-Artikel, dass für den entscheidenden Schritt zum DNA-Gerüst „normale Reaktionsbedingungen“ ausreichend seien, wobei hier mit „normal“ so viel wie „nah an natürlichen Bedingungen“ bedeutet. Diese Aussage ist nur zum Teil richtig. Es trifft zwar zu, dass die Versuchsbedingungen im Vergleich zu vielen anderen Simulationen der Entstehung von Makromolekülen des Lebens relativ einfach waren. Die Versuche wurden in wässrigem Milieu durchgeführt und es wurden keine zwischenzeitlichen Aufreinigungsschritte von Zwischenprodukten vorgenommen. Auch waren keine Veränderungen der Temperatur oder anderer Parameter (pH, Konzentration) nötig. Das klingt in der Tat nach einem beachtlichen Erfolg auf der Suche nach einem plausiblen Szenario für den Ursprung erster Biomoleküle. Allerdings fällt bei näherer Betrachtung der experimentellen Details auf, dass die Versuche geradezu meisterhaft geplant wurden, um DNA-Nukleotide zu erhalten.
Es bedarf keiner vertieften Erörterung, dass die Verwendung hochreiner chemischer Verbindungen (Nukleobasen, Acetaldehyd und D-Glyceraldehyd) in demineralisiertem Wasser – wie in den Versuchen von Teichert et al. geschehen – keineswegs eine Nähe zu natürlichen Bedingungen darstellt. Zudem wurden die Versuche stets in geschlossenen Ampullen durchgeführt, da anderenfalls der flüchtige Acetaldehyd (Siedepunkt 20 °C) aus der Reaktionsmischung schnell entweichen würde. In dem Originalartikel wird der Einsatz geschlossener Ampullen damit begründet, dass auf der frühen Erde ein deutlich höherer Atmosphärendruck geherrscht haben soll – eine kaum überprüfbare Vermutung.
Außerdem wurde mit D-Glyceraldehyd gezielt ein Molekül gewählt, das von seiner geometrischen Beschaffenheit (Konfiguration) her für das anvisierte Resultat genau passend ist. Das Spiegelbild-Molekül L-Glyceraldehyd findet weder in dem scinexx-Artikel noch in der Publikation von Teichert et al. Erwähnung, obwohl dessen Entstehung unter natürlichen Bedingungen genauso wahrscheinlich ist wie diejenige des D-Glyceraldehyds. Die Verwendung von L-Glyceraldehyd anstelle des D-Glyceraldehyds ist problematisch, weil seine entsprechende Reaktion Nukleoside hervorbringt, die für die Bildung von Erbmolekülen aufgrund ihrer Geometrie ungeeignet sind. Selbst wenn der L-Glyceraldehyd nur einen Teil des Gemischs ausmacht, würde das die Synthese von funktionsfähigen DNA-Molekülen wirksam verhindern. Für einen erfolgreichen Reaktionsverlauf ist es also nötig, dass der D-Glyceraldehyd in reiner Form vorliegt. Hier wird also das Problem der Entstehung enantiomerenreiner (nur D-Form oder nur L-Form liegt vor) chemischer Verbindungen ohne gezielte Steuerung durch einen Experimentator schlicht übergangen. Dabei ist jedem Chemiker bekannt, dass die Herstellung enantiomerenreiner chemischer Verbindungen selbst mit fortschrittlichen Methoden der Synthesechemie oft eine Herausforderung ist. Die angebliche Spezifität der von Teichert et al. aufgezeigten Synthese wird auch durch mögliche Reaktionen mit anderen Carbonylverbindungen eingeschränkt. Warum sollten neben D-Glyceraldehyd nicht auch andere Aldehyde vorhanden sein und damit den resultierenden Cocktail in seiner Zusammensetzung komplex werden lassen? Im Hinblick auf die beabsichtigte Synthese von DNA wäre ein solches Gemisch unbrauchbar.
Ein weiteres Problem sind die Ausbeuten der von Teichert et al. veröffentlichten Reaktionen. Während in dem scinexx-Artikel behauptet wird, dass die Ausbeuten „ausreichend“ seien, sieht es in der Originalarbeit nach einem eher dürftigen Ergebnis aus. Die angesprochene Reaktion wurde für alle vier kanonischen Nukleoside durchgeführt. Dabei ergaben sich für drei 2‘-Desoxy-Nukleoside (Adenosin, Guanosin, Thymidin) Ausbeuten von unter einem Prozent. Nur im Fall von 2‘-Desoxy-Cytidin lag die Ausbeute bei immer noch mageren 2,5%. Angesichts des schwerwiegenden präbiotischen „Verdünnungsproblems“ sind diese Resultate in keiner Weise überzeugend.
Es ist noch wichtig zu erwähnen, dass die Reaktion in Gegenwart von Magnesium-Salzen kaum abläuft, wie der Originalliteratur entnommen werden kann. Das aber bedeutet, dass ein in der Erdkruste häufig vorkommendes Ion abwesend sein müsste, damit die Reaktion stattfindet – ein praktisch unüberwindbares Problem für dieses hypothetische Szenario der Entstehung der Bausteine der DNA. Schließlich stellt sich die Frage, warum Teichert et al. die Entstehung von DNA-Bausteinen ohne angefügte Phosphatgruppen simulierten. Denn ohne Phosphatgruppen ist die Weiterreaktion der Bausteine zu DNA-Makromolekülen absolut ausgeschlossen.
Es ist bezeichnend, wie dieses Thema auf der Seite von scinexx dargestellt wurde. Zum einen wurden die Ergebnisse des Originalartikels beschönigt bis hin zu glatten Falschaussagen. Zum anderen wurden kritische Aspekte der Originalarbeit komplett ausgeblendet. Auf diese Weise wirkt der Kommentar manipulativ und nicht im Sinne einer ausgewogenen Berichterstattung. Denn die Originalarbeit von Teichert et al. liefert kein gutes Argument für eine mögliche Entstehung von DNA noch von Desoxy-Nukleosiden unter plausiblen präbiotischen Bedingungen. Vielmehr verdeutlicht die Arbeit erneut, dass Moleküle des Lebens nur mithilfe von ausgefeilter Experimentierkunst hergestellt werden können.
Quellen
Benner SA (2013) Asphalt, Water, and the Prebiotic Synthesis of Ribose, Ribonucleotides and RNA. Acc. Chem. Res. 12, 2025-2034.
Binder H (2009) Neue Synthese für Nukleinsäure-Bausteine- ein plausibler Weg zu ersten Nukleinsäuren? Stud. Integr. J. 16, 111-113.
Deck C, Jauker M & Richert C (2011) Efficient enzyme-free copying of all four nucleobases template by immobilized RNA. Nature Chemistry 3, 603-608.
Ferris JP & Huang W (2006) One-Step, Regioselective Synthesis of up to 50-mers of RNA Oligomers by Montmorillonite Catalysis. J. Am. Chem. Soc. 128, 8914-8919.
Gilbert W (1986) The RNA world, Nature 319, 618.
Lindahl T (1993) Instability and decay of the primary structure of DNA. Nature 362, 709-715.
Powner MW, Gerland B & Sutherland JD (2009) Synthesis of activated pyrimidine ribonucleotides in prebiotically plausible conditions. Nature 459, 239-242.
Schmidtgall B (2014), RNA-Welt: Krise überwunden? Stud. Integr. J. 21, 22-28.
Teichert JS, Kruse FM & Trapp O (2019) Directed prebiotic pathway of DNA nucleosides. Angew. Chem. 131, 10049-10052; Angew. Chem. Int. Ed. 58, 9944-9947.
Autor dieser News: Boris Schmidtgall
© 2019, http://www.genesisnet.info/schoepfung_evolution/n268.php
Zurück zur Artikel-Übersicht: https://www.wort-und-wissen.org/publikationen/genesisnet/
07.01.19 Schritte zum Leben ohne Enzyme?
Als Erklärungsansatz für eine natürliche Entstehung des Lebens wird derzeit die sogenannte RNA-Welt-Theorie favorisiert. Aufgrund ihrer Defizite wird aber auch ein prinzipiell anderer Ansatz untersucht: die „Stoffwechsel-zuerst“-Theorie. Demnach sollen nicht RNA-Moleküle, sondern Reaktionsnetzwerke oder -zyklen (Stoffwechsel) aus kleinen organischen Molekülen zuerst entstanden sein. Die Forschungsgruppe um Joseph Moran veröffentlichte kürzlich zwei Artikel, in denen Prozesse, die im Zusammenhang mit der Kohlenstofffixierung stehen, als mögliches Modell für einen urtümlichen Stoffwechselweg vorgeschlagen werden. Die Autoren behaupten in ihren Ausführungen, wichtige Hinweise auf geochemisch plausible Vorgänge erhalten zu haben, die am Anfang des organismischen Lebens, wie wir es kennen, gestanden haben könnten. Hält das Modell einer kritischen Untersuchung stand?
Alle bekannten Lebensformen beruhen auf hochgradig komplexen und vernetzten biochemischen Vorgängen. Der reibungslose Ablauf dieser Vorgänge ist allerdings nur unter Beteiligung hochspezifischer und anspruchsvoll gebauter Proteine (Enzyme) möglich, die wiederum ihrerseits anhand der Information des Erbguts zusammengebaut werden. Zusammen mit weiteren unverzichtbaren molekularen Bausteinen (Cofaktoren, Fette, Zucker) erscheint die minimal erforderliche Komplexität von Organismen außerordentlich groß. Die unmittelbare Entstehung einer Urzelle („LUCA“, last universal common ancestor) durch natürliche Vorgänge erscheint daher keinem Wissenschaftler als plausibel. Folglich wird im Rahmen von evolutionstheoretischen Modellen angenommen, dass schrittweise chemische Vorgänge zunächst die unverzichtbaren molekularen Bausteine des Lebens hervorgebracht haben sollen, welche sich dann zu den aktuell bekannten biochemischen Funktionseinheiten und schließlich zu Organismen organisiert haben sollen. Hierbei haben sich im Wesentlichen zwei gegensätzliche Herangehensweisen zur Erklärung des Lebensursprungs herausgebildet: die „RNA-Welt“-Theorie1 und die „Stoffwechsel-zuerst“-Theorie.2
Auch wenn die Mehrheit der Lebensursprungsforscher die „RNA-Welt“ als Modell für den Anfang des Lebens bevorzugt, motivieren dessen mannigfaltige Erklärungsdefizite (Schmidtgall 2013), z. B. die ausgeprägte Labilität der RNA-Bausteine, zur Untersuchung der alternativen Idee, die allerdings auch zahlreiche schwerwiegende Schwächen aufweist. Die kritische Frage für „Stoffwechsel-zuerst“-Theorien stellt sich in Bezug auf katalytisch wirksame Proteine: Wie können Stoffwechselvorgänge am Anfang des Lebens gestanden haben, wenn alle derzeit bekannten vergleichbaren Vorgänge auf hochkomplexe Enzyme (katalytische Proteine) angewiesen sind? Ausgehend von dieser Fragestellung werden daher so genannte „enzymfreie“ Stoffwechselvorgänge untersucht, die als mögliche Modelle für einen Ursprung des Lebens ohne komplexe Proteine dienen sollen.
Aktuell befasst sich die Forschungsgruppe um Joseph Moran an der Universität Strasbourg (Frankreich) mit Experimenten, die wichtige experimentelle Daten für das Stoffwechsel-zuerst-Modell liefern sollen. Der Konzeption ihrer experimentellen Arbeit liegt die Annahme zugrunde, dass aktuell bekannte zentrale Stoffwechselvorgänge den erdgeschichtlich frühen Vorläufern sehr ähnlich oder gar mit ihnen identisch sind. Die Auffassung, dass die Chemie der urtümlichen Stoffwechselnetzwerke von derjenigen heutiger Organismen wesentlich verschieden war und sich erst später zur heutigen entwickelte, lehnt Morans Gruppe ab: „Obwohl diese Herangehensweise wichtig ist, schafft sie unvermeidlich eine tiefe Kluft zwischen der angeführten präbiotischen Chemie und der Biochemie heutiger Organismen, die sie eigentlich zu erklären sucht“ (Muchowska et al. 2017).
Als Untersuchungsgegenstand wählte die Gruppe um Moran Vorgänge, die mit der Kohlenstofffixierung im Zusammenhang stehen. Dabei handelt es sich um molekulare Prozesse, bei denen Kohlenstoffdioxid aus der Atmosphäre aufgenommen wird, damit daraus Stoffe gebildet werden, aus denen Gewebe aufgebaut werden kann, wie es auch heute in Pflanzen und einigen Mikroorganismen geschieht. Die dabei gebildeten chemischen Verbindungen sind energiereich und dienen deshalb vielen anderen Organismen als Nahrungsquelle. Die Kohlenstofffixierung kann daher als Basis des heute existierenden Lebens aufgefasst werden und gilt deshalb auch als guter Kandidat für den chemischen Vorgang, der den Anfang für organismisches Leben, wie wir es heute kennen, gelegt haben könnte.
Da davon ausgegangen wird, dass die Atmosphäre zu Beginn der Erdgeschichte frei von Sauerstoff war, werden CO2-Fixierungsvorgänge in anaerob (ohne Sauerstoff) lebenden Mikroorganismen als mögliche „Wiege des Lebens“ betrachtet. Als besonders gut geeignete Kandidaten gelten hierbei der reverse Citratzyklus (rCZ) und der Wood-Ljungdahl-Weg (auch reduktiver Acetyl-CoA-Weg). Diese beiden physiologischen Vorgänge werden von anaerob lebenden Bakterien zur Synthese des chemischen Grundbausteins Acetat aus CO2 genutzt. In beiden Fällen handelt es sich um Stoffwechselwege, die nur in Abwesenheit von Sauerstoff ablaufen, da einige der beteiligten Enzyme sehr empfindlich gegenüber Oxidation durch Sauerstoff sind. Da alle beteiligten Enzyme bei weitem zu komplex für ein plausibles präbiotisches Szenario sind, wurden in der Gruppe um Moran Versuche unternommen, hypothetische enzymfreie Versionen des rCZ (zumindest teilweise) aufzubauen (s. Abb. 1). Der rCZ ist zudem von besonderer Relevanz, weil er autokatalytisch ist, d. h. dass in diesem Zyklus ein molekularer Baustein seine eigene Vermehrung katalysiert – in Analogie zu Organismen, die sich unter Aufnahme von Materie und Energie vermehren.
Abb. 1: Schematische Darstellung des reversen Citratzyklus.
Befunde der Arbeit
In einer ersten Publikation zu diesem Thema (Muchowska et al. 2017) behaupten die Autoren, dass es ihnen gelungen sei, einen großen Teil des reversen Citratzyklus ohne Enzyme aufzubauen. Sie geben dabei an, sechs der elf Reaktionen, aus denen der reverse Citratzyklus aufgebaut ist, ohne Beteiligung von Enzymen und in Gegenwart weniger verschiedener Metallionen realisiert zu haben. Die Reaktionen konnten bei hohen Temperaturen (140 °C) und in stark saurem Milieu (pH = 0-1) durchgeführt werden. Die Autoren um Moran folgern, dass dieser Befund die Plausibilität eines enzymfreien rCZ-Wegs als präbiotischem Vorgang stützt und sind überzeugt, dass diese Ergebnisse Anlass zu der Hoffnung gäben, dass es – im Sinne einer zukunftsweisenden Perspektive – gelingen könnte, ein präbiotisches Reaktionsnetzwerk ohne Beteiligung von Enzymen zu charakterisieren, welches den AcCoA-Weg und den rCZ-Weg beinhaltet.
In einer weiteren Arbeit befasste sich die Gruppe um Moran (Varma et al. 2018) mit dem Aufbau essentieller C2 und C3-Bausteine (Acetat und Pyruvat, s. Abb. 1) aus CO2 an der Oberfläche von Partikeln verschiedener Metalle in elementarer Form (Fe0, Ni0, Co0). Dabei wurden Versuche unternommen, Bedingungen zu finden, die mit denjenigen der zuvor beschriebenen Arbeit zum enzymfreien rCZ kompatibel wären. Auf diese Weise sollte ein vollständiges Modell für die Entstehung eines urtümlichen biochemischen Vorgangs aufgestellt werden. Die Reaktionen der Versuchsreihe wurden in den meisten Fällen bei einem hohen Druck von 35 bar3 CO2 (ohne andere Gase) und einer Temperatur von 140°C in wässriger Lösung geführt. Bei den Versuchen konnte tatsächlich die Bildung von Acetat und Pyruvat an der Oberfläche der elementaren Metalle nachgewiesen werden. Diesen Befund werteten die Autoren als sicheren Hinweis dafür, dass es „auffällige Parallelen zwischen einer plausiblen präbiotischen Chemie und frühen chemischen Prozessen der Kohlenstofffixierung, die von primitiven, autotrophen Organismen genutzt wurden“ gäbe. Dies stütze die Hypothese, so die Autoren, dass die Geochemie eine wichtige Rolle in der Entstehung des Lebens gespielt habe.
Kritik
Auch wenn die angesprochenen Experimente der Gruppe um Moran wohl durchdacht und elegant sind, können die zugrundegelegten Bedingungen in keiner Weise als präbiotisch bezeichnet werden. Wie in der Laboratoriumschemie üblich, wurden ausschließlich gereinigte Chemikalien verwendet (z. B. Metalle mit über 99% Reinheit, hochreines Wasser). Für die Experimente zum Aufbau präbiotischer Zyklen wurden chemische Verbindungen am Anfang in fertiger Form vorgelegt. Eine der Verbindungen (Oxalosuccinat) war so empfindlich, dass sie durch aufwändige chemische Synthese kurz vor dem Versuch hergestellt werden musste, da sie sich auch bei schonender Lagerung schnell zersetzte. In einigen Fällen wurden den Reaktionen bestimmte Verbindungen portionsweise zugesetzt. Auch die Behauptung, dass die Reaktionsbedingungen, die im Reaktor eingestellt wurden, mit heißen Untersee-Quellen („Schwarze Raucher“) vergleichbar wären, ist nicht gerechtfertigt, da keine unterseeischen Quellen bekannt sind, in deren Umgebung ein pH-Wert von ca. 0-1 gegeben ist. Zudem sind solche Quellen angefüllt mit einem Reichtum an verschiedenen Mineralien, unter denen sicherlich auch solche vorliegen, die die Bildung chemischer Reaktionsnetzwerke stören würden. Dagegen wurden von Morans Gruppe nur Versuche mit einer oder zwei Ionensorten durchgeführt. Interessanterweise wurde auch festgestellt, dass die Reaktionsketten in Gegenwart von Molybdän-Ionen überhaupt nicht ablaufen. Es wäre sicherlich auch interessant zu sehen, wie die Reaktionen bei Vorhandensein verschiedener Kombinationen von drei oder vier oder auch einer größeren Anzahl an Metallionen verlaufen wären. Doch ist kein solcher Versuch protokolliert worden. Die Vermutung, dass unter solchen Bedingungen, die der Realität deutlich näher wären, nicht das aus Sicht der Autoren gewünschte Ergebnis eingetreten wäre, liegt nahe.
Bei den Reaktionen von CO2 im Druckreaktor mit verschiedenen Metallen konnten zwar mit Acetat und Pyruvat biologisch wichtige Verbindungen nachgewiesen werden, allerdings erst, nachdem die Metalloberfläche mit hochkonzentrierter, wässriger Natriumhydroxid-Lösung (7.5 M!) behandelt wurde. Bei Verzicht auf diesen Schritt hafteten die chemischen Verbindungen (Pyruvat, Acetat) weiterhin an der Metalloberfläche und konnten nicht nachgewiesen werden. Es bedarf keiner näheren Erläuterung, dass derart hohe Konzentrationen an Natriumhydroxid keinerlei Bezug zu einem realistischen Szenario für die Entstehung der ersten Lebewesen haben.
Angesichts der unrealistischen Versuchsbedingungen ist die durchweg optimistische Interpretation der Befunde durch die Autoren kaum nachvollziehbar. Zunächst einmal ist zu konstatieren, dass überhaupt kein Stoffwechselzyklus beobachtet worden ist. Es wurden lediglich zwei getrennte Reaktionsabfolgen zu je drei Reaktionsschritten konstruiert (Schritte 2-4 und 7-9, s. Abb. 1). Zudem handelte es sich bei den Reaktionsschritten um relativ leicht zu realisierende chemische Reaktionen: Dehydratisierung, Reduktion einer C-C-Doppelbindung bzw. einer Keto-Gruppe. Hierbei handelt es sich um Reaktionen, die nicht notwendigerweise einer Enzym-Katalyse bedürfen, weswegen sie möglicherweise als vielversprechender Forschungsgegenstand für enzymfreie „präbiotische“ Stoffwechselwege ausgesucht worden sind. Dagegen wurden die anspruchsvollen Reaktionen wie die reduktiven Carboxylierungen (Schritte 6 und 10, s. Abb. 1) oder die Lyase-Reaktion (Schritt 1, s. Abb. 1) in den Artikeln kaum thematisiert. Es ist nicht schwer zu verstehen, weshalb über präbiotische Analoga solcher Reaktionen auch in den Publikationen der Gruppe um Moran keine Information zu entnehmen ist: Es handelt sich um sehr anspruchsvolle Reaktionen, die über labile Thioester-Intermediate und unter ATP4-Verbrauch verlaufen. Solche Reaktionen können unter wässrigen Bedingungen nicht realisiert werden, es sei denn in Gegenwart hochkomplexer Enzyme, da Thioester sich im wässrigen Medium rasch zersetzen (Hydrolyse). Enzyme hingegen können in speziellen hydrophoben Kavitäten unter Wasserausschluss solche Vorgänge verwirklichen.
Ein weiterer kritischer Punkt, der bereits von Orgel (2008) diskutiert worden ist, wurde von der Gruppe um Moran nicht genügend gewürdigt: Der rCZ-Zyklus setzt sich aus Komponenten zusammen, die hinsichtlich Struktur und Reaktivität sehr ähnlich sind. Daher ist zu erwarten, dass in es Abwesenheit von Enzymen zu einer Vielzahl an unerwünschten Reaktionen und schließlich zum Erliegen des Reaktionsnetzwerks kommt, wenn alle Verbindungen in demselben Raum vorliegen und identischen Bedingungen ausgesetzt sind. Gemäß den Schilderungen der Gruppe von Moran wurden verschiedene Teile des rCZ getrennt durchgeführt. In Organismen dagegen liegen alle Verbindungen in einem Raum vor. Das zentrale Problem hierbei ist die fehlende Spezifität der chemischen Reaktionen in Abwesenheit von Enzymen. Orgel kommentierte dies wie folgt: „Es ist eher das Fehlen der Spezifität als ein Mangel an Effizienz, das die wesentliche Barriere für die Existenz komplexer autokatalytischer Zyklen von beliebiger Art darstellt.“
Doch ein Kernproblem der „Stoffwechsel-zuerst“-Hypothese wird sowohl von Moran als auch von Orgel nicht erwähnt: Für die Entstehung eines Organismus bedarf es gleichzeitig sowohl der katabolischen (abbauenden) als auch der anabolischen (aufbauenden) Stoffwechselwege. Zudem sind in Lebewesen unzählige Stoffwechselwege miteinander verknüpft. Wie es zur Entstehung eines solchen Systems durch ungerichtete chemische Reaktionen gekommen sein soll, scheint angesichts der schwerwiegenden Probleme selbst relativ einfache präbiotische Analoga physiologischer Prozesse zu modellieren weit außerhalb des Erklärbaren zu liegen.
Der grundsätzliche Irrtum, der hier vorliegt, geht aus folgender Aussage von Moran (2018) hervor: „Es ist daher möglich, sich viele plausible geologische Szenarien vorzustellen, […] in genereller Übereinstimmung mit der Idee, dass der Stoffwechsel entstand, damit aufgestaute Redoxgradienten zwischen dem reduzierten Eisen der Erdkruste und einer vergleichsweise stark oxidierten CO2-reichen Atmosphäre sich entladen können.“ Zur Veranschaulichung des Inhalts dieser Aussage sei folgende Analogie angeführt: „Es gibt viele denkbare Szenarien, in denen eine Turbine mitsamt einem Kraftwerk durch natürliche Prozesse entstand, damit die potentielle Energie eines Stausees sich ins Tal entladen konnte.“ Auch wenn letztere Aussage unsinnig klingt, hat sie im Prinzip eine vergleichbare Bedeutung wie das Zitat von Moran. Das Vorliegen eines energetischen Potentialgefälles und dessen Entladung sind für die Entstehung eines komplexen Energieverwerters bei weitem nicht hinreichend.
Literatur
Muchowska KB et al. (2017) Metals promote sequences of the reverse Krebs cycle. Nat. Ecol. Evol. 1, 1716-1721.
Orgel LE (2008) On the implausibility of metabolic cycles on the prebiotic earth. PloS Biology 6, e18.
Schmidtgall B (2013) RNA-Welt: Krise überwunden? Studium Integrale Journal 20, 16-22. (http://www.wort-und-wissen.de/sij/sij211/sij211-3.html)
Varma SJ et al. (2018) Native iron reduces CO2 to intermediates and endproducts of the acetyl-CoA pathway. Nat. Ecol. Evol. 2, 1019-1024.
Anmerkungen
1 Nach dieser Theorie entstanden zunächst genetische Moleküle, RNA (engl. ribonucleic acid), die fähig waren, sich selbst zu replizieren. Anschließend soll sich um diese „RNA-Welt“ allmählich ein vollständiger Stoffwechsel entwickelt haben.
2 Gemäß dieser Denkweise standen Netzwerke aus chemischen Reaktionsketten (Stoffwechselvorgänge) kleiner organischer Moleküle am Anfang des Lebens. Diese Reaktionsnetzwerke sollen dann durch das Hinzukommen genetischer Moleküle stabilisiert worden sein.
3 Der gewöhnliche Atmosphärendruck liegt bei 1 bar.
4 Adenosintriphosphat, die allgemeine „molekulare Energiewährung“ in Organismen.
Autor dieser News: Boris Schmidtgall
2019, http://www.genesisnet.info/schoepfung_evolution/n264.php
24.11.18 Ursuppe richtig gemischt? Große Sicherheit bei unklarer Faktenlage
Für eine glaubwürdige Hypothese zum Ursprung des Lebens bedarf es eines realistischen Modells für die geochemischen Randbedingungen. Vor kurzem wurde in einer Publikation der Zeitschrift Astrobiology von Computersimulationen zu einem Szenario berichtet, in welchem Schwefeldioxid eine wichtige Rolle spielt. Die Untersuchungen wurden durchgeführt, um die Plausibilität eines früher beschriebenen Modells des Lebensursprungs (Patel et al. 2015) zu verbessern. Die Ergebnisse wurden kurz darauf auf der Internetseite wissenschaft.de kommentiert. Es zeigt sich einmal mehr, dass zwischen den tatsächlichen Inhalten wissenschaftlicher Artikel und der populärwissenschaftlichen Berichterstattung eine erhebliche Diskrepanz vorliegt: Den Lesern werden die Schwierigkeiten und spekulativen Annahmen von Modellen zum Ursprung des Lebens regelmäßig verschwiegen.
Die Bezugnahme auf übernatürliche Kräfte in wissenschaftlichen Artikeln ist eher unüblich. In populärwissenschaftlichen Berichten verhält es sich jedoch manchmal anders, insbesondere dann, wenn es um die Frage nach dem Ursprung des Lebens geht. Vor einigen Monaten wurde auf der Internetseite wissenschaft.de in dem Text „Brodelnde Ursuppe“ (Burczyk 2018) kurz darüber berichtet, dass wichtige Hinweise auf die Chemie des Lebensursprungs erhalten wurden. Dabei war die Rede von „höllischen Verhältnissen“, die den Eindruck erwecken, dass „hier der Teufel kocht“.
So dramatisch wie der Einstieg in den kurzen Text war allerdings der wissenschaftliche Befund, von dem berichtet wurde, bei weitem nicht. Es handelte sich lediglich um Resultate relativ trockener Computersimulationen zu möglichen geochemischen Bedingungen, die zur Zeit der ersten Lebensformen auf der Erde geherrscht haben sollen (Ranjan et al. 2018). In dem Fachartikel wurde anhand von rein theoretischen Berechnungen die Hypothese aufgestellt, dass dem Gas Schwefeldioxid eine wichtige Rolle bei der Entstehung der chemischen Systeme des Lebens zukomme. Das Ziel der Arbeit war eine Verbesserung der Plausibilität des Lebensursprungs-Modells von Patel et al. (2015). Dass dieses Modell auf falschen Voraussetzungen gegründet ist und folglich irreführende Schlussfolgerungen gezogen wurden, hat Herkert (2015) treffend analysiert. Unter anderem wurde von Patel ohne stichhaltige Begründung angenommen, dass das Hydrogensulfidion (HS–) eine wesentliche Rolle in den ersten chemischen Netzwerken, aus denen drei der wichtigsten Bausteine des Lebens (Nukleotide, Lipide und Aminosäuren) hervorgegangen sein sollen, gespielt habe. Nun ging auch aus den Berechnungen von Ranjan et al. hervor, dass die Anreicherung urzeitlicher Gewässer mit Hydrogensulfid-Salzen nicht ausreichend gewesen sein dürfte, weswegen SO2 als alternative Schwefel-Quelle angenommen wurde.
Die Berechnungen von Ranjan et al. sind dabei alles andere als trivial und betreffen chemische Gleichgewichte und Zusammensetzungen der Atmosphäre und der Gewässer. Dabei ist eine Vielzahl an Parametern wie UV-Strahlung, pH-Wert, chemische Reaktionen, Temperatur, Löslichkeit in Wasser, Vorkommen bestimmter Mineralien etc. zu berücksichtigen. Selbst heute dürfte eine genaue Erklärung und Vorhersage der Dynamik von Atmosphäre und Geosphäre eine fortwährende Herausforderung für viele Expertenteams sein – wie viel mehr gilt das für Zustände, die lange vor unserer Zeit liegen und deren genaue Bedingungen unbekannt sind. Daher konnten die Autoren um Ranjan es nicht vermeiden, für ihre Berechnungen starke Vereinfachungen anzunehmen. So gehen sie z. B. davon aus, dass das Gewässer, in dem die chemischen Bestandteile des Lebens entstehen, absolut homogen ist – eine unrealistische, aber für das erhoffte Ergebnis nötige Voraussetzung. Es wurden noch weitere gewagte Annahmen gemacht, z. B. ein hoher atmosphärischer CO2– Gehalt von 0,9% (heute: 0,04%), damit die Berechnung am Ende zum gewünschten Ergebnis führt, worauf hier nicht detailliert eingegangen werden soll. Jedoch kann festgehalten werden, dass die Schlussfolgerungen des Artikels keineswegs zuverlässig sind.
Die Autorin des Berichts auf wissenschaft.de erwähnt solche solche „Details“ allerdings mit keinem Wort. Sie beschreibt die Schlussfolgerungen von Ranjan et al., als gäbe es keinen Grund, sie zu hinterfragen. Dabei wird das gängige erdgeschichtliche Narrativ erneut, wie so oft in vergleichbaren Artikeln, mantraartig wiederholt: Zu Beginn enthielt die Atmosphäre keinen Sauerstoff, es gab eine intensive Aktivität der Vulkane, die eine große Vielfalt an chemischen Verbindungen ausspien. Die Moleküle bildeten anschließend lebenswichtige Bausteine usw. Dass dieser hypothetische Verlauf auf vielen unbegründeten Annahmen und Spekulationen beruht, kommt dabei nicht zur Sprache.
Der Artikel von Ranjan et al. ist ein weiteres gutes Beispiel dafür, wie erwünschte Ergebnisse mithilfe passender Annahmen erzeugt werden. Die spekulative Natur der Arbeit von Ranjan et al. hätte in dem Bericht auf wissenschaft.de im Sinne einer objektiven und der Wahrheitssuche dienenden Berichterstattung zumindest erwähnt werden müssen. So aber bestätigt sich ein weiteres Mal die erhebliche Kluft zwischen tatsächlichen Befunden der Lebensursprungsforschung und ihrer unrealistisch optimistischen Wiedergabe in populärwissenschaftlichen Artikeln.
Literatur
Burczyk J (2018) Brodelnde Ursuppe. https://www.wissenschaft.de/bildervideos/bild-der-woche/brodelnde-ursuppe/, abgerufen am 11. 10. 2018.
Herkert J (2015) Herkunft von RNA, Proteinen und Fettsäuren aufgeklärt? Studium Integrale Journal 22, 114-116. (http://www.wort-und-wissen.de/sij/sij222/sij222-10.html)
Patel et al. (2015) Common origins of RNA, protein and lipid precursors in a cyanosulfidic protometabolism. Nat. Chem. 7, 301-307.
Ranjan S et al. (2018) Sulfidic anion concentrations on early earth for surficial origins-of-life chemistry. Astrobiology 18, 1023-1040.
Autor dieser News: Boris Schmidtgall
© 2018, http://www.genesisnet.info/schoepfung_evolution/n263.php
Zurück zur Artikel-Übersicht: https://www.wort-und-wissen.org/publikationen/genesisnet/
31.03.18 Lebensspuren unter extremen Wüstenbedingungen – auch auf anderen Himmelskörpern?
In den Medien erregen Meldungen mit Hinweisen auf Leben irgendwo im All große Aufmerksamkeit. Die Lektüre offenbart dann, dass die Hinweise in sehr optimistischen Interpretationen von wenigen Befunden beruhen und somit eher Wunschträumen oder Erwartungshaltungen der Öffentlichkeit entspringen. Hier einige aktuelle Forschungsergebnisse und deren Einordnung und Bewertung.
Gebiete in der Atacama-Wüste im Westen Südamerikas (im Süden Perus und in Chile) zählen zu den trockensten Lebensräumen der Erde. Nach den äußerst seltenen Niederschlägen zeigt sich, dass sich auch hier Leben entfalten kann, wenn die entsprechenden Wüstenregionen für begrenzte Zeit aufblühen. Die meiste Zeit aber stellt diese Region enorme Herausforderung an jegliche Art von Lebewesen.
Ein umfangreiches internationales Wissenschaftlerteam hat nun untersucht, ob unter den in der Atacama-Wüste vorherrschenden Bedingungen wie extreme Trockenheit, sehr salzige Böden und ausgeprägter Nährstoffmangel mikrobielles Leben dauerhaft möglich ist. Die Forscher sammelten Proben im Jahre 2015 – nach dem letzten nennenswerten Niederschlagsereignis – sowie in den beiden darauffolgenden Jahren (2016 und 2017), in denen keine Niederschläge verzeichnet worden waren. Sie konnten anhand von Proben an verschiedenen geographischen Regionen zeigen, dass sowohl die Biomasse als auch die Vielfalt der Mikroorganismen mit zunehmender Trockenheit abnimmt. Unter den extremen Lebensbedingungen ist es schwierig, Leben überhaupt zuverlässig nachzuweisen. Daher verwendeten die Autoren unterschiedliche Kriterien für den Nachweis von mikrobiellem Leben. Sie konnten vier verschiedene Hinweise auf dauerhaft lebende Mikroben (neben den sehr robusten Sporen, die manche Bakterien bilden) aufzeigen: (a) die physikalisch-chemische Beschaffenheit des Bodens, der durch Pflanzen nach einem der sehr seltenen Regenereignisse nutzbar ist; (b) den Nachweis von Biomolekülen, die auf aktive Zellen hinweisen, wie ATP, Phospholipide, Stoffwechselprodukte und enzymatische Aktivität; (c) messbare Verdopplungsraten von Genomen in Bodenproben und (d) spezifische Zusammensetzung der Mikrobengemeinschaften, abhängig von Qualität des Bodens und der Tiefe, aus der die Proben genommen wurden.
Aus ihren Befunden leiten die Autoren ein Arbeitsmodell für den Mars ab, obwohl sie davon ausgehen, dass die dort herrschenden Bedingungen noch extremer sind. Sie gehen davon aus, dass wenn sich je Leben auf dem Mars entwickelt haben sollte, Überreste davon in Nischen unter der Oberfläche zu finden sein könnten. Für die Erde wissen wir, dass es hier Lebewesen gibt, die uns immer wieder mit erstaunlichen Eigenschaften überraschen. Belege dafür, dass es auf dem Mars jemals Leben gegeben hat, fehlen allerdings bisher!
Über die Möglichkeiten außerirdischen Lebens wird nicht nur im Zusammenhang mit dem vergleichsweise erdnahen Planeten Mars spekuliert, auch andere Himmelkörper werden unter astrobiologischen Fragestellungen ins Blickfeld genommen. In einer NASA-Mission (2004-2017) wurden mit der Raumsonde Cassini (und Huygens) Saturn und seine Monde untersucht. Im Rahmen dieser Mission wurden am Südpol des Saturnmondes Enceladus Wasserdampf-Fahnen dokumentiert. Diese Befunde führten bereits 2008 zu Spekulationen über Leben auf diesem Mond (McKay et al. 2008). Weitere Daten wurden als Hinweise auf hydrothermale Prozesse interpretiert, die unter der Eisdecke dieses Himmelskörpers ablaufen könnten. In jüngeren Publikationen werden neben Wasser auch Methan (CH4), Kohlenstoffdioxid (CO2), Ammoniak (NH3), molekularer Stickstoff (N2) und Wasserstoff (H2) nachgewiesen (Waite et al. 2017) und damit die Vermutung hydrothermaler Vorgänge auf Enceladus erhärtet.
Taubner et al. (2018) haben jetzt unter der Annahme, dass zwischen dem als steinern angenommenen Kern und der vereisten Oberfläche des Saturnmondes in flüssigem Wasser geochemische Prozesse bei gemäßigten Temperaturen (< 100 °C) ablaufen, die Idee geprüft, ob ein Teil des Methans biologischen Ursprungs sein könnte. Sie konnten im Labor unter simulierten Enceladus-Bedingungen zeigen, dass Methan produzierende Archaebakterien unter den dort angenommenen Drücken CO2 in CH4 umwandeln. Damit könnte, so schlussfolgern die Autoren, ein Teil des nachgewiesenen CH4 biologischen Ursprungs sein und damit auf Leben hinweisen.
Auch dieser indirekte Hinweis, dass es auf Enceladus möglicherweise Lebewesen geben könnte, ist stark von der Überzeugung geprägt, dass biologische Systeme auch an anderen Orten im Universum unter geeigneten Bedingungen zu erwarten sind, ohne Absicht und entsprechende Steuerung. Für diese Überzeugung gib es jedoch keinen Anlass und bisher liegt auch kein empirischer Beleg für extraterrestrisches Leben vor.
Literatur
McKay CP, Porco CC, Altheide T, Davis WL & Kral TA (2008) The possible origin and persistence of life on Enceladus and detection of biomarkers in the plume. Astrobiology 8, 909–919.
Schulze-Makuch et al. (2018) Transitory microbial habitat in the hyperarid Atacama desert. Proc. Nat. Acad. Sci. USA; doi: 10.1073/pnas.1714341115.
Taubner R-S, Pappenreiter P, Zwicker J, Smrzka D, Pruckner C, Kolar P, Bernacchi S, Seifert AH, Krajete A, Bach W, Peckmann J, Paulik C, Firneis M, Schleper C & Rittmann SK-MR (2018) Biological methane production under putative Enceladus-like conditions. Nat. Comm.9, 748; doi: 10.1038/s41467-018-02876-y.
Waite JH et al. (2017) Cassini finds molecular hydrogen in the Enceladus plume: evidence for hydrothermal processes. Science 356, 155–159.
Autor dieser News: Harald Binder
© 2018, http://www.genesisnet.info/schoepfung_evolution/n258.php
Zurück zur Artikel-Übersicht: https://www.wort-und-wissen.org/publikationen/genesisnet/
3.03.17 Mikrofossilien: Hinweis auf sehr frühe Lebensspuren?
Eine jüngst erschienene Publikation von Geowissenschaftlern zu mikroskopischen Strukturen in einer der vermutlich frühesten Gesteinsformationen, die auf der Erde verfügbar ist, ist von den Tagesmedien aufgenommen worden. Dabei wurden die fachliche Interpretation der Befunde und die Überlegungen zu deren möglicher Entstehung in einer Weise popularisiert, als wären Fossilien mit spektakulärem Alter entdeckt worden. Im Folgenden soll verdeutlicht werden, dass die Interpretation durchaus nicht trivial ist und dass sie weitreichende Fragen eröffnet, die weder in den Medien noch im Original angesprochen werden.
Das Gestein des Nuvvuagittuq-Gürtels in der Nähe von Quebec (Kanada) birgt nach derzeitigen Erkenntnissen eine der ältesten eisenhaltigen Strukturen unserer Erde. Das Alter dieser Formation wird von Fachleuten kontrovers diskutiert – manche geben aufgrund von radiometrischen Uran-Blei (U-Pb)-Messungen an Zirkonkristallen ein Alter von 3,774-3,751 Milliarden radiometrischen Jahren an, während andere aufgrund von Samarium-Neodym (146Sm-142Nd)-Daten für bestimmte Einheiten von einem Alter von bis zu 4,280 Milliarden radiometrischen Jahre ausgehen. Die Zusammensetzung der Mineralien unterstützt eine Vorstellung, nach welcher der Ursprung dieser Gesteine im Meerwasser in der Nähe von hydrothermalen Quellen liegt sowie unter dem Einfluss von Vulkanismus gestanden hat.
Dodd et al. 2017 haben aus dieser Formation Proben genommen und untersucht. Sie dokumentieren Befunde, die sie als fossile Hinweise auf sehr frühe mikrobische Lebensformen interpretieren. So fanden sie mikroskopische faserartige Strukturen aus Hämatit, einem Eisenoxid (Fe2O3), 2 bis 14 µm breit und bis zu 0,5 mm lang, in einer Jaspis-Matrix. Ähnliche Strukturen sind aus dem Phanerozoikum („Zeitalter sichtbarer Lebewesen“, ca. 541 Millionen rad. Jahre bis heute) bekannt: aus Lokken, Norwegen (ca. 480 Millionen rad. Jahre) und dem Franciscan-Komplex in Kalifornien (ca. 180 Millionen rad. Jahre). Die beschriebenen Filamente ähneln ebenso Strukturen in heutigen Ablagerungen an hydrothermalen Quellen mit niedriger Temperatur, bei denen diese Strukturen bekanntermaßen von Eisen-oxidierenden Bakterien gebildet werden.
Weiter dokumentieren die Autoren zylindrische Röhren aus feinkörnigem Hämatit, die von Quarzkörnern umgeben und ausgefüllt sind. Ähnliche Röhren finden sich auch in Jaspis aus anderen fossilen Überresten von hydrothermalen Quellen, wo sie Eisen-oxidierenden Bakterien zugeschrieben werden. Dodd et al. fassen die Beobachtungen an den mikroskopischen Strukturen in Jaspis in 5 Punkten zusammen:
- Die Röhren enthalten im Inneren Hämatit-Filamente,
- am Ende mancher Röhren finden sich Hämatitknoten, wie sie von Röhren, die von Mikroben gebildet werden, in der geologischen Überlieferung bekannt sind,
- der Röhrendurchmesser ist mit 16-30 µm relativ gleichförmig, vergleichbar mit anerkannten fossilen Mikrofossilien,
- wie bei heutigen Eisen-oxidierenden Bakterien weisen die Röhren ungefähr dieselbe Ausrichtung auf und
- die Röhren treten zusammen mit unterschiedlichen Mineralien wie Apatit und Karbonat auf.
Um zu prüfen, ob diese mikroskopischen Strukturen tatsächlich biogenen Ursprungs sind (also von Lebewesen stammen), suchten die Autoren nach rein abiogenen Mechanismen für deren Entstehung (d. h. sie wählten als Nullhypothese, dass die beschriebenen Strukturen nicht von Lebewesen stammen). Doch keiner der heute bekannten Prozesse oder deren Kombination, wie z. B. Fließsysteme, Fällungsreaktionen, Selbstanordnungen, Diagenese konnten die Entstehung der beschriebenen Strukturen befriedigend erklären. Daraufhin verwarfen die Autoren die Nullhypothese der rein anorganischen Entstehung der mikroskopischen Strukturen.
Gründe für Deutung als Lebensspuren. Dodd et al. schreiben, dass sie aufgrund des Aktualismus davon ausgehen, dass auch die von ihnen beschriebenen fossilen Strukturen mineralisierte Überreste mikrobiologischer Aktivitäten sind.1 Sie begründen dies mit vielen Beispielen in der ganzen geologischen Überlieferung und auch aus der Gegenwart, dass Mikroorganismen Hämatitröhren in der Umgebung hydrothermaler Quellen verursachen.
Die Entscheidung, dass es sich um Lebensspuren handelt, wird aus Sicht der Autoren durch weitere Befunde gestützt: Organischer Kohlenstoff von Mikroorganismen kann durch bio- und geochemische Prozesse zu Karbonat oxidiert werden. So kann man in entsprechenden Formationen kleine, ringförmige Plättchen (Rosetten) aus Karbonatmineralien finden, in die noch kohlenstoffhaltige (graphitartige) Partikel eingestreut sind. Dodd et al. beschreiben mikroskopische Kalzit-Rosetten, in denen sie durch Raman-Spektroskopie auch Graphitpartikel nachweisen konnten. Auch die Isotopenverteilung von 13C in Karbonaten und Graphit sind verträglich mit der Vorstellung eines mikrobiologischen Ursprungs der Fossilien. Die Autoren führen auch das Vorkommen von Phosphaten – biochemisch bedeutsame Verbindungen – in Form von Apatit an. Die einzelnen Phänomene können aber unter bestimmten geochemischen Bedingungen auch ohne Beteiligung von Organismen, also rein anorganisch entstehen.
In jüngeren Ablagerungen sind kleine Graphitpartikel, die mit Magnetit, einem Eisenoxidmineral (Fe3O4) überzogen sind, bekannt (z. B. aus der Mozaan-Gruppe in Südafrika; Progolum: 2,9 Milliarden rad. Jahre). Für deren Entstehung werden Eisen-oxidierende Mikroben angenommen. Ähnliche Partikel mit einem Durchmesser von 100-500 µm finden sich auch in den von Dodd et al. untersuchten Jaspis-Proben. Die Autoren fügen ihrem Artikel eine Vielzahl von mikroskopischen Aufnahmen bei, anhand derer sie Vergleiche zu jüngeren Fossilien anstellen, bei denen eine Beteiligung von Organismen bei der Entstehung angenommen wird.
Die Erfahrung zeigt, dass mikroskopische Strukturen für unterschiedliche Interpretationen offen sind und so ist damit zu rechnen, dass dieser Befund kontrovers diskutiert werden wird, vor allem auch aufgrund seines angegebenen spektakulären Alters von 3,77 (oder vielleicht sogar 4,28) Milliarden rad. Jahren.
Bewertung. Zunächst einmal soll hier festgehalten werden, dass die vorgelegten Belege keineswegs zwingend oder unwiderleglich für eine Beteiligung von Lebewesen bei der Entstehung der untersuchten Proben sprechen. Die Versuchung, spektakulär alte fossile Hinweise auf Leben zu präsentieren, kann den Blick trüben für Aspekte, die dem eher widersprechen. Die zu erwartende kritische Diskussion der Fachleute wird diese Aspekte – vermutlich weniger spektakulär – ans Licht bringen. Die Diskussion um die Interpretation der vorgelegten mikroskopischen Gesteinsstrukturen hat erst begonnen und ist nicht zuletzt auch von der Faszination gefährdet, etablierte Grenzen mutig und öffentlichkeitswirksam zu überschreiten (wobei der Effekt durch grenzwertig plakative Formulierungen und Darstellungen in populären Medien noch verstärkt wird2).
Worin liegt eigentlich die Brisanz dieses Befundes und seiner Interpretation als derzeit ältester fossiler Beleg für Leben auf der Erde? Die derzeitigen lehrbuchmäßigen Modelle gehen davon aus, dass die Erde ca. 4,6 Milliarden Jahre alt ist. Angesichts der gängigen Vorstellungen zur Planetenentstehung ist es sehr erstaunlich und bisher nicht verstanden, wie bereits zu einem so frühen Zeitpunkt in der Geschichte der Erde Leben vorkommen und fossil erhalten bleiben kann. Das würde bedeuten, dass in den ältesten Gesteinsformationen bereits vorhandenes Leben fossil dokumentiert ist. Es wäre quasi von Anfang an da! Wenn einige der Autoren in Interviews, von denen Ausschnitte in Zeitungen3 und per Video4 weite Verbreitung finden, sich dahingehend äußern, dass der Befund auch so verstehbar sei, dass Leben ganz einfach entstehen kann und deshalb vielleicht auch an anderen Orten im Universum zu erwarten sei, dann gibt es dafür derzeit keinen empirischen Beleg; solche Aussagen sind unbegründet und von Zirkelschlüssen geprägt. Zum anderen ist die Behauptung, dass Leben womöglich ganz einfach entsteht, ein Schlag ins Gesicht derer, die sich seit den ersten naturalistischen Spekulationen von Oparin (1938) vergeblich bemühen, Möglichkeiten der Entstehung von Leben im Labor nachzuvollziehen. Es ist erstaunlich und aufgrund etablierter Vorstellungen schwer verständlich, dass fossile Lebensspuren sehr früh auftauchen. Woher kommt dieses Leben? Wie könnte es zustande gekommen sein? Das bleiben offene und zu erforschende Fragen! Jedenfalls ist es wünschenswert, dass Proben dieser Art weiter intensiv untersucht werden. Sollte sich der bisherige Trend bestätigen, dass sehr früh in der Erdgeschichte Lebensspuren auftreten, dann sind etablierte Vorstellungen herausgefordert und gezwungen, eine wie auch immer geartete „natürliche“ Entstehung des Lebens von der Erde weg an einen andern Ort im Universum zu verlegen. In einem an biblischen Texten orientierten schöpfungstheoretischen Ansatz dagegen sind Gegebenheiten, wie sie durch die hier vorgestellten Interpretationen nahegelegt werden, zu erwarten.
Literatur
Dodd MS, Papineau D, Grenne T, Slack JF, Rittner M, Pirajno F, O´Neil J & Little CTS (2017) Evidence for early life in earth´s oldest hydrothermal vent precipitates. Nature 543, 60-64.
Anmerkungen
1 „Uniformitarianism, epitomised by younger examples of microbially produced haematite tubes in hydrothermal vent precipitates throughout the geological record, leads us to conclude that the haematite tubes and filaments within the NSB jaspers are the mineralized remains of bacterial sheats and extracellular filaments.“
2 Spektrum: Sind das die ältesten Spuren des Lebens? http://www.spektrum.de/news/sind-das-die-aeltesten-spuren-des-lebens/1440080
NZZ: Hinweis auf Leben vor 4 Milliarden Jahren. https://www.nzz.ch/wissenschaft/biologie/fossilienfund-hinweis-auf-leben-vor-vier-milliarden-jahren-ld.148740
FAZ: Fossilienfund deutet auf Leben vor vier Milliarden Jahren hin. http://www.faz.net/aktuell/wissen/erde-klima/revolutionaerer-fossilienfund-deutet-auf-leben-vor-vier-milliarden-jahren-hin-14904999.html
Spiegel online: http://www.spiegel.de/wissenschaft/natur/fossilien-sollen-mindestens-3-7-milliarden-jahre-alt-sein-a-1136922.html
3 Video von University College, London, z. B.: https://www.youtube.com/watch?v=3E83c8yoID0 (9.3.2017)
4 Z.B.: Washington Post vom 1.3.2017 (dort ist ebenfalls das oben genannte Video verlinkt): https://www.washingtonpost.com/news/speaking-of-science/wp/2017/03/01/newfound-3-77-billion-year-old-fossils-could-be-earliest-evidence-of-life-on-earth/?utm_term=.9afad26a4308
Die Journalisten Sarah Kaplan schreibt dort: „If their results are confirmed, they will boost a belief that organisms arose very early in the history of earth – and may find it just as easy to evolve on worlds beyond our own.” Weiter zitiert sie Matthew Dodd: „The process to kick-start life may not need significant length of time or special chemistry, but could actually be a relatively easy process to get started” said Matthew Dodd, a biogeochemist at University College London and lead author of the paper. „It has big implications for whether life is abundant or not in the universe.”
Autor dieser News: Harald Binder
© 2017, http://www.genesisnet.info/schoepfung_evolution/n246.php
Zurück zur Artikel-Übersicht: https://www.wort-und-wissen.org/publikationen/genesisnet/
09.05.16 Chemie der Lebensentstehung: Tiefseeschlote im Brennpunkt
Hydrothermalen Tiefseequellen nahe der Mittelozeanischen Rücken wird in vielen Szenarien zur Lebensentstehung eine bedeutende Rolle zugeschrieben. Nachdem die besonderen Bedingungen in den porösen Schloten bereits für die Synthese von RNA-Molekülen modelliert worden sind, wurde das Modell jetzt für kleinere Moleküle durchgerechnet. Offene Fragen und Hindernisse für eine plausible Wirksamkeit der Systeme bleiben aber unberücksichtigt.
Hydrothermale Tiefseequellen, die schwarzen oder auch weißen Raucher im Bereich der Mittelozeanischen Rücken, tauchen seit ihrer erstmaligen Beschreibung Mitte der 1970-er Jahre regelmäßig in Szenarien zur Entstehung des Lebens auf. Die in dem bis zu über 400° C heißen Wasser gelösten Mineralien werden ausgefällt, wenn die heiße Lösung durch Kontakt mit dem kalten Ozeanwasser (ca. 3° C) rasch abkühlt und sich so der namengebende „Rauch“ bildet. Aus diesen ausgefällten Mineralien bauen sich dann mit der Zeit die Schlote auf, aus denen das stark aufgeheizte, mit Mineralien übersättigte Wasser aus der Tiefe an die Oberfläche des Ozeanbodens aufsteigt. Der poröse Aufbau dieser Schlote inspirierte Dieter Braun und seine Kollegen dazu, die Porenräume genauer zu studieren und die Auswirkungen von Temperaturgradienten in Röhren mit kleinen Querschnitten zu modellieren. Sie konnten zeigen, dass durch Thermophorese, also einem durch die Temperaturunterschiede verursachten Transport, kurze Nukleinsäuremoleküle in kapillaren Röhren angereichert werden können (Baaske et al. 2007). Diese Erkenntnisse wurden ebenso zur Entwicklung technischer Geräte genutzt wie auch zum Etablieren von Mechanismen zur Anreicherung von Biomolekülen im Zusammenhang mit der Chemie zur Lebensentstehung (Binder 2011, Imming 2015).
Abb. 1: Unterseeischer Vulkan vom Typ „Schwarzer Raucher“. (Wikimedia: P. Rona / OAR/National Undersea Research Program (NURP); NOAA – NOAA Photo Library, Public Domain)
Nun hat eine Gruppe von Wissenschaftlern ein solches thermophoretisches System in einer Modellrechnung genutzt, um die Anreicherung von Formamid (NH2CHO) zu modellieren (Niether et al. 2016). Formamid hat in den Spekulationen zu präbiotischen Synthesen von Biomolekülen eine lange Tradition. Es lässt sich zwar analytisch fast überall nachweisen, jedoch in so geringen Konzentrationen, dass nicht nachvollziehbar ist, wie es bei der Synthese von Biomolekülen von Bedeutung sein kann. Die numerischen Modellierungen ergeben wie für die Nukleinsäuremoleküle unter entsprechenden Randbedingungen eine Anreicherung aus sehr verdünnten Formamidlösungen (10-3 Gewichts-%) auf 85 Gewichtsprozent. Bei Konzentrationen dieser Größenordnung scheint die Synthese z. B. von Stickstoffheterozyklen wie den Basen der Nukleinsäuren vorstellbar, wie die Autoren das im Titel ihrer Arbeit zum Ausdruck bringen.
Damit kann man die Veröffentlichung als ein weiteres Beispiel dafür betrachten, dass nur in begrenztem Umfang neue Erkenntnisse dokumentiert werden, diese aber durch die Verknüpfung mit dem die Fantasie anregenden Themenfeld der präbiotischen Lebensentstehung an prominenter Stelle erscheinen und damit die Chance haben, große Öffentlichkeitswirkung zu erzielen.
Bei einer kritischen Reflexion der Bedeutung der Thermophorese in porösen Schloten von heißen Tiefseequellen für die präbiotische Synthese von Biomolekülen bleibt eine Reihe von Fragen bisher unbeantwortet. Inwieweit spiegeln die modellierten Prozesse reale Abläufe in den Tiefseeschloten wieder? Ist thermophoretische Anreicherung von Stoffen im Allgemeinen und organischer Verbindungen im Besonderen dort nachweisbar? Sollte das der Fall sein, dann erhebt sich weiter die Frage, ob dieser Anreicherungsprozess irgendwelche Selektivität zeigt. Sollten sich die bisherigen Modellrechnungen bestätigen, dann scheint die Anreicherung eher allgemeinen Charakter zu haben. Das aber würde zu einer Lösung führen, die eine höhere Konzentration an vielen vorhandenen Chemikalien enthält und damit wenig zu einer spezifischen Synthese von erforderlichen Biomolekülen beitragen kann.
Insofern bleibt festzuhalten, dass thermophoretische Anreicherung in kapillaren Systemen ein sehr interessantes Phänomen ist, das technisch manche interessante Anwendung zu ermöglicht. Ob dieser Prozess tatsächlich in der Natur abläuft, bleibt ebenso zu zeigen wie auch, ob er das Potential hat, präbiotische Synthesen in irgendeiner Weise nachhaltig und spezifisch zu beeinflussen.
Literatur
Baaske P, Weinert FM, Duhr S, Lemke KH, Russell MJ & Braun D (2007) Extreme accumulation of nucleotides in simulated hydrothermal pore systems. Proc. Natl. Acad. Sci. USA 104, 9346-9351.
Binder H (2012) Wurde die RNA-Welt am Grunde des Ozeans etabliert? Stud. Int. J. 19, 61-62.
Imming P (2015) Schritte ungeplanter, ungelenkter Entstehung von DNA und RNA? Stud. Int. J. 22, 42-45.
Niether D, Afanasenkau D, Dhont JKG & Wiegand S (2016) Accumulation of formamide in hydrothermal pores form prebiotic nucleobases. Proc. Natl. Acad. Sci. USA 113, 4272-4277.
Autor dieser News: Harald Binder
© 2016, http://www.genesisnet.info/schoepfung_evolution/n236.php
Zurück zur Artikel-Übersicht: https://www.wort-und-wissen.org/publikationen/genesisnet/
29.01.15 Chemie im Kosmos – Moleküle für das Leben?
Populäre Medien verbreiten nicht selten irreführende Meldungen über aktuelle Forschungsergebnisse. Ein aktuelles Beispiel ist die Behauptung, man habe Leben in den Tiefen des Weltalls gefunden. Tatsächlich wurden nur relativ kleine organische Moleküle nachgewiesen, die allenfalls indirekt in einem Zusammenhang mit Leben stehen könnten. Auch aus dem interstellaren Raum sind derzeit keine chemischen Prozesse bekannt, die die nötigen Bausteine lebender Zellen bereitstellen.
Über chemische Vorgänge im Kosmos haben wir vergleichsweise wenig empirische* Erkenntnisse. Auf der Erde gefundene Überreste von Meteoriten können untersucht werden, außerdem sind durch menschliche Aktivitäten im Weltraum von dort Proben verfügbar und wir können elektromagnetische Strahlung, die die Erde aus dem Kosmos erreicht, spektroskopisch analysieren und die Spektren interpretieren.
*empirische (= durch Erfahrung gewonnene)
Aus dem interstellaren Raum* sind derzeit etwa 180 organische Moleküle aufgrund ihrer Spektren dokumentiert. Das Physikalische Institut der Universität Köln präsentiert auf einer Internetseite eine Zusammenstellung der Moleküle (http://www.astro.uni-koeln.de/cdms/molecules) sowie der Literaturzitate, in denen ihr Nachweis beschrieben wird. Mit dem derzeit weltgrößten Radioteleskop (Atacama Large Millimeter/submillimeter Array, ALMA) haben Belloche et al. (2014) in einer Region mit der Bezeichnung Sagittarius B2(N) erfolgreich nach weiteren Molekülen gesucht. Diese Region befindet sich nahe des Zentrums unserer Galaxie und fällt durch massive Sternenproduktion auf.
*interstellarer Raum (= Raum zwischen den Sternen bzw. den Galaxien)
Bereits zuvor hatten Belloche et al. (2009) in dieser Region den Nachweis für Propylcyanid erbracht. Dieses und weitere vergleichsweise kleine Moleküle werden häufig hinsichtlich ihres Potentials zur Synthese komplexerer Moleküle diskutiert, die dann in einen Zusammenhang mit biologischen Systemen (Astrobiologie) gestellt werden. Bislang sind das rein hypothetische Konzepte, es wurden bisher im interstellaren Raum noch keine biologischen Systeme gefunden.
In ihrer jüngsten Arbeit dokumentieren Belloche et al. (2014) den spektralen Nachweis von iso-Propylcyanid. Dies gelang durch Vergleich von Spektren aus dem oben genannten interstellaren Bereich und modellierten (berechneten) Spektren. Die Autoren diskutieren, dass i-Propylcyanid ein geeigneter Baustein zur Synthese von Aminosäuren mit verzweigter C-Kette wie z. B. Valin und Leucin sein könnte und damit eventuell einen bedeutsamen Beitrag zur Astrobiologie leisten könnte.
Mit großem Erstaunen kann man dann allerdings in populären Medien von „Biomoleküle in der Milchstraße“ (Der Tagesspiegel, 26. 9. 2014) lesen oder gar „Deutsche Forscher entdecken Leben in den Tiefen des Alls“ (BILD 26. 9. 2014). Titel dieser Art mögen zwar Leser animieren, haben aber mit wissenschaftlichen Befunden nichts zu tun.
Das im interstellaren Raum spektroskopisch identifizierte i-Propylcyanid ist kein biologisch relevantes Molekül. Der astrobiologische Aspekt kommt erst durch die entsprechende Diskussion ins Blickfeld und damit wird ein eigentlich wenig spektakulärer Befund popularisiert. Wenn das aber von der Tagespresse noch ins Extreme getrieben wird, ist das irreführend.
Literatur
Belloche A, Garrod RT, Müller HSP & Menten KM (2014) Detection of a branched alkyl molecule in the interstellar medium: iso-propyl cyanide. Science 345, 1584-1587.
Belloche A, Garrod RT, Müller HSP, Menten KM, Comito C & Schilke P (2009) Increased complexity in interstellar chemistry: detection and chemical modeling of ethyl formiate and n-Propyl cyanide in Sagittarius B2(N). Astron. Astrophys. 499, 215-232.
Autor dieser News: Harald Binder
© 2015, http://www.genesisnet.info/schoepfung_evolution/n223.php
Zurück zur Artikel-Übersicht: https://www.wort-und-wissen.org/publikationen/genesisnet/
30.09.14 Tetrapyrrole – Biokatalysatoren der ersten Stunde?
Zahlreiche Schlüsselfunktionen im Ablauf von physiologischen Vorgängen heutiger Organismen werden von zyklischen Molekülen übernommen, die als Tetrapyrrol-Makrozyklen bezeichnet werden. Daher besteht großes Interesse an der Formulierung einer schlüssigen Hypothese für deren Abiogenese*. Bisherige Versuche der Simulation von Vorgängen, die zur Bildung dieser Verbindungen geführt haben sollen, ergeben jedoch keine gute Basis für ein plausibles Modell der erstmaligen Bildung von Tetrapyrrol-Makrozyklen.
*Abiogenese (= erstmalige Entstehung auf physikalisch-chemischem Weg, ohne Voraussetzung von Leben)
Relevanz von Tetrapyrrol-Makrozyklen
Aufgrund ihres häufigen Vorkommens in unterschiedlichen biochemischen Funktionseinheiten, ihrer auffälligen Geometrie und der faszinierenden chemischen und physikalischen Eigenschaften sind Tetrapyrrole seit langem Gegenstand intensiver Untersuchungen. Zu den bekanntesten Beispielen gehören die Aufklärung der Struktur des grünen Blattfarbstoffs Chlorophyll (Willstätter & Fischer 1913) und des „roten Blutfarbstoffs“ Hämoglobin (Fischer & Zeile 1929). Bei Tetrapyrrolen handelt es sich um flache (planare), ringförmige Moleküle, die aus vier gleichen Untereinheiten zusammengesetzt sind. Zu den in der Natur am häufigsten vorkommenden Makrozyklen dieses Typs zählen Porphin 1, Chlorin 2 und Corrin 3 (s. Abb. 1).

Abb. 1: In Organismen häufig vorkommende Tetrapyrrol-Makrozyklen und der Metallion-Komplex M 1.
Aufgrund ihrer Stabilität kommen diese Verbindungen in größerer Menge in Sedimenten, Kohle und Erdöl vor (Schaeffer et al. 1993). Ihre ringförmige Struktur ermöglicht das Binden bestimmter Metallionen (s. Abb. 1), die einen Radius von 60-70 pm aufweisen (z. B. Mg2+ im Chlorophyll oder Co2+ im Vitamin B12). Größere Metallionen wie Pb2+ (Blei), passen nicht ins Zentrum der cyclischen Verbindungen, während zu kleine Ionen wie Be2+ (Beryllium) oder Al3+ (Aluminium) nicht fest gebunden werden. Verbindungen aus Tetrapyrrolen und Metallionen werden als „Komplexe“ bezeichnet und spielen bei zahlreichen physiologischen Vorgängen in Organismen eine zentrale Rolle. Für die Photosynthese ist das Chlorophyll (Mg2+-Porphyrin-Komplex) als Bestandteil des Lichtsammelkomplexes unverzichtbar. Der Sauerstoff-Transport im Blut vieler Lebewesen erfolgt durch das Hämoglobin, ein Enzym, in dessen Zentrum ein Fe2+-Porphyrin Komplex als Bindestelle für molekularen Sauerstoff fungiert. Weitere wichtige Funktionen von Metall-Tetrapyrrol-Komplexen sind die Beteiligung an Entgiftungsprozessen in der Leber (Monooxygenasen) und der Elektronentransport in der Atmungskette (Q-Cytochrom-c-Oxidoreduktase und Cytochrom-c-Oxidase).
Das Vorkommen porphinoider Ni2+-Komplexe bei Archaebakterien gilt als Indiz dafür, dass diese Verbindungen bereits in einem frühen Stadium der angenommenen schrittweisen Lebensentstehung eine wichtige Rolle gespielt haben könnten (Eschenmoser 1988). Der Weg zur Entstehung von Tetrapyrrolen galt jedoch lange Zeit als ungeklärt. In den vergangenen Jahren hat die Forschungsgruppe um Lindsey Hypothesen für die präbiotische Entstehung dieser Verbindungen auf der Basis von experimentellen Untersuchungen etabliert (Lindsey et al. 2009, Lindsey et al. 2011).
Analyse der Plausibilität des Modells zur Biogenese von Tetrapyrrol-Makrozyklen
Schon die gezielte Laborsynthese von Porphin 1 (s. Abb. 1) stellte bis vor kurzem noch eine beträchtliche Herausforderung dar. Im Jahr 1959 wurde eine Porphin-Synthese mit einer Ausbeute von mageren 5% in einer Publikation des Journal of Organic Chemistry beschrieben (Krol 1959). Vermutlich galten deshalb experimentelle Arbeiten zu Hypothesen über die präbiotische Entstehung dieser Verbindungen lange als wenig attraktiv. Erst im Jahr 2007 gelang es der Arbeitsgruppe um Lindsey, den Magnesium-Komplex Mg-1 des Porphins in einer Ausbeute von 30% herzustellen (Lindsey 2007). Allerdings handelte es sich dabei um eine reine Laborsynthese, die für eine Diskussion potentieller präbiotischer Vorgänge ungeeignet ist. Der erste Versuch, eine Entstehung von Tetrapyrrol-Verbindungen unter als präbiotisch bezeichneten Bedingungen zu simulieren, wurde von Mauzerall durchgeführt (Mauzerall 1960). Bei diesen Versuchen wurde jedoch eine organische Verbindung (Porphobilinogen PBG) eingesetzt, deren abiogenetische Entstehung nicht als gegeben betrachtet werden kann. Zudem wurde nur eine Vorstufe (Uroporphyrinogen III, s. Abb. 3 unten) der physiologisch relevanten Makrozyklen Porphin 1, Chlorin 2 und Corrin 3 erhalten. In einer Reihe von aktuellen Publikationen beschrieb die Gruppe um Lindsey nun Ergebnisse ihrer experimentellen Arbeiten, die eine mögliche Lösung für das zuerst genannte Problem der früheren Arbeiten (Entstehung von PBG) darstellen sollen.
Als Rahmenbedingungen für die Simulationen wurden eine anaerobe Atmosphäre, die Abwesenheit von Enzymen und das Vorhandensein höherer Konzentrationen an Aminolävulinsäure (ALA) und eines β-Ketoesters (KE) (Reaktion I, s. Abb. 2) oder eines 2,4-Diketons (1‑AcOH) (Reaktion II, s. Abb. 2) in einer wässrigen Lösung angenommen. ALA wurde als Ausgangsverbindung in den Experimenten gewählt, da dieses Molekül auch in der Biosynthese (in lebenden Zellen) stets der Ausgangspunkt für die Bildung von Tetrapyrrol-Makrozyklen ist (Marks 1966). Auf diese Weise sollte demonstriert werden, dass heutige physiologische Vorgänge ihren Ursprung in chemischen Reaktionsabläufen ohne Beteiligung von Enzymen haben. Allerdings sind weder KE noch 1-AcOH in der Biosynthese von Porphyrinen involviert. Diese Verbindungen wurden bei den Simulationsexperimenten eingesetzt, da die Kondensation von ALA mit sich selbst ohne Steuerung durch Enzyme hauptsächlich zum Dihydropyrazin (DHP) führt und nicht zum PBG (Reaktion III, s. Abb. 2).

Abb. 2: Von LINDSEY untersuchte Reaktionen zur Bildung von PBG und dessen strukturelle Analoga.
Die Reaktionsbedingungen wurden hinsichtlich der Parameter Temperatur (70-100 °C bzw. 28-85 °C), pH-Wert (5-7) und Konzentration der Reaktionspartner (2-40 mM bzw. 5-240 mM) variiert, um zu belegen, dass diese Reaktionen keiner allzu spezifischen Bedingungen bedürfen (robuste Reaktion). Bei den durchgeführten Reaktionen konnte in einer maximalen Ausbeute von 10% der Makrozyklus Uroporphyrinogen III (s. Abb. 2) als Gemisch mit einigen Nebenprodukten erhalten werden. In diesen Versuchen wurde folglich die spontane Organisation von acht einfachen, acyclischen Molekülen zu einer relativ komplexen Verbindung (Tetrapyrrol) nachgewiesen. Nach Ansicht der Autoren eignen sich diese Befunde als Indiz für die Plausibilität der spontanen Selbstorganisation von Katalysatoren, metabolischen Zyklen und Vorläufern von Photosynthese-Systemen.
Gemäß Lindsey handelt es sich bei der untersuchten Reaktion um ein beeindruckendes Beispiel der Selbstorganisation von acht acyclischen Molekülen (4 x ALA + 4 x KE oder 4 x ALA + 4 x 1-AcOH) zu einem Tetrapyrrolgerüst (Lindsey 2011). Allerdings deutet die Ausbeute von maximal 10% an, dass die Reaktion nicht der hauptsächlich ablaufende Prozess ist. Die tatsächliche Hauptreaktion ist die Polymerisation. Zudem ist mit diesen Befunden keinesfalls der Nachweis für die Abiogenese von Tetrapyrrolen erbracht, die in den bereits erwähnten biologischen Funktionseinheiten vorkommen. Bei allen beschriebenen Experimenten wurde kein Protoporphyrin IX (s. Abb. 2) erhalten, sondern nur die metabolische Vorstufe Uroporphyrinogen III (s. Abb. 3). Für die Weiterreaktion zum Protoporphyrin IX (unmittelbare Vorstufe vom Häm bzw, Chlorophyll) wären noch einige weitere Schritte notwendig, darunter vier regioselektive Decarboxylierungen und zwei Oxidationsschritte (s. Abb. 3).
Abb. 3: Biosynthese des Häm-Systems als Beispiel für die biologische Entstehung von Porphyrinen.
Diese Reaktionen verlaufen in Zellen in unterschiedlichen Kompartimenten und unter Beteiligung von Enzymen. Besonders die Katalyse der Decarboxylierungen durch das Enzym Uroporphyrinogen III-Decarboxylase erweist sich als spektakulär, denn die Beschleunigung der Reaktionsgeschwindigkeit beträgt 6 x 1024 M-1. Es handelt sich dabei um die effizienteste Reaktionsbeschleunigung durch ein Enzym, die bisher bekannt geworden ist (Lewis 2008). Das bedeutet aber auch im Umkehrschluss, dass die entsprechende unkatalysierte Reaktion extrem langsam ist. Folglich ist dieser Vorgang auf die Katalyse angewiesen. Dazu passt auch der Befund (With 1975), dass die unkatalysierte Decarboxylierung nur unter sehr harschen Bedingungen abläuft (200 °C, 5 min). Auch die darauf folgenden Oxidationen von Coproporphyrinogen III und Protoporphyrin IX sind unter den von Lindsey gewählten Bedingungen problematisch, da in Gegenwart oxidierender Reagenzien die Ausgangsverbindung ALA nicht beständig wäre. Überhaupt ist die chemische Verbindung ALA nur bei niedrigem pH-Wert (2.3) und unter anoxischen Bedingungen wenige Monate haltbar. Auch Lindsey und Mitarbeiter berichteten, dass diese Verbindung bei einer Temperatur von -15 °C aufbewahrt werden musste (Lindsey 2009). Diese Eigenschaft zeichnet sie als hochgradig ungeeignet für eine längere Verweildauer in einer präbiotischen Welt aus. Zumindest kann ALA nicht in einer von Lindsey vorausgesetzten „warmen Welt“ als Ausgangsverbindung angenommen werden.
Das entscheidende Problem ist jedoch die nicht einmal im Ansatz behandelte Fragestellung, wie porphinoide Verbindungen sich mit anderen Makromolekülen zu den eigentlich wirksamen biologischen Strukturen (Photosysteme, Hämoglobin, Porphyrin-haltige Enzyme) verknüpft haben könnten. Enzyme, die z. B. Häm-Einheiten enthalten, sind auf die Proteinhülle angewiesen, da anderenfalls die Spezifität der Reaktionen nicht gegeben wäre. Im Zusammenhang mit der Stoffwechsel-zuerst-Hypothese bezeichnete Orgel das Fehlen der Spezifität einfacher Vorgänger von späteren komplexeren Enzymen als das ungelöste Kernproblem (Orgel 2008): „Die größte Herausforderung für Verfechter von Metabolismus-zuerst-Hypothesen – die durch das Fehlen der Spezifität nichtenzymatischer Katalysatoren verursachten Probleme – sind generell nicht berücksichtigt worden.“1 Verknüpfende Reaktionen mit porphinoiden Verbindungen dürften allerdings ohne geeignete Katalysatoren äußerst schwer zu realisieren sein, da Porphyrine aufgrund ihrer hohen thermodynamischen Stabilität ausgesprochen reaktionsträge sind. Sie stellen folglich eher eine Sackgasse auf dem Weg zu komplexen biologischen Strukturen dar als eine realistische Zwischenstufe.
Die Bildung porphinoider Verbindungen bedarf einer spezifischen Katalyse
Zusammenfassend gesagt kann auf der Grundlage bisheriger Experimente kein schlüssiges Modell für die Entstehung porphinoider Verbindungen formuliert werden. Trotz ihrer thermodynamischen Stabilität bedarf es einer gezielten Steuerung der chemischen Reaktionen durch komplexe und spezialisierte Enzyme, damit aus einfachen Vorläufern wie ALA die Tetrapyrrole 1–3 gebildet werden können.
Anmerkung
1„The most serious challenge to proponents of metabolic cycle theories – the problems presented by the lack of specifity of most nonenzymatic catalysts – has, in general, not been appreciated.“
Literatur
Eschenmoser A (1988), Vitamin B12: Experimente zur Frage nach dem Ursprung seiner molekularen Struktur, Angew. Chem. 100, 5-40.
Fischer H & Zeile K (1929), Synthese des Hämatoporphyrins, Protoporphyrins und Haemins, Justus Liebiegs Ann. Chem. 468, 98-116.
Krol S (1959), A New Synthesis of Porphyrin, J. Org. Chem. 24, 2065–2067.Lewis CA & Wolfenden R (2008). Uroporphyrinogen decarboxylation as a benchmark for the catalytic proficiency of enzymes, Proc. Natl. Acad. Sci. U.S.A. 105, 17328–33.
Dogutan DK, Ptaszek M & Lindsey JS (2007), Direct Synthesis of Magnesium Porphine via 1-Formyldipyrromethane, J. Org. Chem. 72, 5008-5011.
Lindsey JS et al. (2009), Simple Formation of an Abiotic Porphyrinogen in Aqueous Solution, Orig. Life Evol. Biosph. 39, 495-515.
Lindsey JS et al. (2011), Abiotic formation of uroporphyrinogen and coproporphyrinogen from acyclic reactants, New J. Chem. 35, 65-75.
Marks GS (1966), The biosynthesis of heme and chlorophyll, The Botanical Review 32.1, 56-94.
Mauzerall D (1960), The condensation of porphobilinogen to uroporphyrinogen. J. Am. Chem. Soc. 82, 2605-2609.
Orgel LE (2008), The Implausibility of Metabolic Cycles on the Prebiotic Earth, PLoS Biology 6, e18.
Schaeffer P et al. (1993), Extraction of bound porphyrins from sulfur-rich sediments and their use for reconstruction of palaeoenvironments, Nature 364, 133.
Willstätter R & Fischer M (1913), Untersuchungen über Chlorophyll XXIII. Die Stammsubstanzen der Phylline und Porphyrine, Justus Liebigs Ann. Chem. 400, 182-194.
With TK (1975), Decarboxylation of Uroporphyrin by Heating at Atmospheric Pressure, Biochem J. 147, 249-251.
Gastbeitrag von Boris Schmidtgall
Autor dieser News: Studiengemeinschaft Wort und Wissen
© 2014, http://www.genesisnet.info/schoepfung_evolution/n218.php
Zurück zur Artikel-Übersicht: https://www.wort-und-wissen.org/publikationen/genesisnet/
09.05.14 Eiserner Zugang zu ersten Stoffwechselreaktionen?
In Modellen zur Entstehung des Lebens wird nach Hinweisen gesucht, ob die genetische Information oder Stoffwechselreaktionen für eine erste Phase von größerer Bedeutung sind. Die uns bekannten Zellen als kleinste Einheiten von Lebewesen benötigen immer beides und noch viel mehr. Liefern die hier vorgestellten chemischen Reaktionen wirklich neue Einblicke in Prozesse, die zu ersten Zellen führen?
Lebende Systeme – von einfachen Zellen bis zu komplexen vielzelligen Organismen – sind u.a. dadurch charakterisiert, dass sie Biomakromoleküle enthalten, mit deren Hilfe sie Information speichern, replizieren und nutzen können, und Stoffwechsel betreiben. Durch vernetzte chemische Reaktionsabläufe werden in Zellen Nährstoffe umgewandelt, zum Teil in Komponenten, die am Aufbau der Zelle beteiligt sind. Dabei werden auch nutzbare Energie und Reduktionsäquivalente gewonnen.
In Diskussionen über den Ursprung des Lebens werden häufig Positionen einander gegenübergestellt, in denen entweder die zeitliche Priorität der informationsspeichernden Nukleinsäuren oder die des Stoffwechsels behauptet wird. Alle bekannten Lebewesen – ohne Ausnahme – weisen aber gleichzeitig beides auf, und wir haben Leben bisher nie anders kennengelernt!
Die Glykolyse und der Pentosephosphat-Zyklus sind zwei im Stoffwechsel bedeutsame Reaktionsabfolgen. Die beiden Reaktionsabfolgen ermöglichen es den allermeisten Lebewesen, Kohlenhydrate abzubauen bzw. sie zu verwerten. Keller et al. (2014) haben mit einer von ihnen etablierten Analysenmethode (Flüssigkeitschromatographie mit einem Massenspektrometer gekoppelt; LC-MS) 12 phosphathaltige Zuckerkomponenten in wässrigen Lösungen bei erhöhter Temperatur untersucht. Zunächst untersuchten die Autoren jede der 12 Verbindungen in reinem Wasser bei 70°C nach 5 Stunden. Unter diesen Bedingungen wandeln sich manche der untersuchten Chemikalien in andere um – sie zerfallen. Die gebildeten Zersetzungsprodukte lassen den Rückschluss zu, dass 17 Reaktionsschritte abgelaufen sind, die auch an der Glykolyse und am Pentosephosphat-Zyklus beteiligt sind. Wenn Keller und Mitarbeiter das reine Wasser durch simuliertes Ozeanwasser ersetzten, fanden sie 28 Reaktionen, die in den beiden genannten biochemischen Reaktionszyklen auch stattfinden. Um Ozeanwasser zu simulieren, wurden reinem Wasser verschiedene Metallsalze zugefügt. Wenn Eisen (Fe) als zweiwertiges Eisen (Fe2+) zugefügt und der Sauerstoffgehalt (O2) stark verringert wurde, konnten sogar 29 verschiedene Reaktionen nachgewiesen werden. Unter diesen Bedingungen liefen alle nachgewiesenen Reaktionen im Vergleich zu höherem O2– Gehalt und Fe3+ sehr viel schneller ab, es ergaben sich also höhere Reaktionsgeschwindigkeiten. Die phosphathaltigen Zuckerverbindungen wurden in den Versuchen in Konzentrationen eingesetzt (100 µM), die typischerweise etwas geringer sind als die Konzentrationen der Verbindungen in Zellen.
Unter Bedingungen mit simuliertem Ozeanwasser wurden insgesamt 12,3 % des gesamten Kohlenstoffs (C) aus den Ausgangsstoffen in Stoffwechselprodukte der Glykolyse und des Pentosephosphat-Zyklus umgewandelt; 37,6 % waren in Form der eingesetzten Ausgansstoffe erhalten geblieben und 51,1 % lagen nach der 5-stündigen Reaktionszeit in nicht identifizierter Form vor, also als Verbindungen, die im betrachteten Zusammenhang keine Rolle spielen sollten. Wurde das Eisen im simulierten Ozeanwasser als Fe2+ eingesetzt und O2 stark verringert, dann fanden sich 11,9 % des C in neu gebildeten phosphathaltigen Zuckerverbindungen, 49,9 % der Ausgangsverbindungen lagen nach 5 Stunden bei 70°C noch vor und 38,2 % in Form von nicht identifizierten Stoffen. Die Autoren bezeichnen die Bedingungen mit Fe2+ und nur Spuren von O2 als urzeitlich („Archean ocean“).
Nun mag diese Studie unter bestimmten Gesichtspunkten interessant sein, aber wenn z. B. Luisi (2014) in einem begleitenden Kommentar zu der Arbeit von Keller et al. von „einem enzymfreien, stoffwechselähnlichen Reaktionsnetzwerk“1 schreibt, dann handelt es sich dabei vornehmlich um suggestive Formulierungen. Etwa 12 % des eingesetzten C lässt sich in phosphathaltigen Verbindungen nachweisen, die durch thermodynamisch begünstigte Zerfallsreaktionen aus den Ausgangsverbindungen entstanden sind. Bis zur Hälfte des C wird dagegen in nicht relevante Verbindungen umgewandelt. Der von Keller et al. verwendete Begriff der Spezifität ist durch nichts in dieser Untersuchung gerechtfertigt (vielleicht am ehesten noch im Blick auf die Wirkung von Fe2+ mit wenig O2 im Vergleich zu Fe3+ bei normalem O2-Gehalt). Da von möglichst reinen Substanzen ausgegangen wird, sind viele Nebenreaktionen überhaupt nicht im Blickfeld; über Spezifität kann also gar keine Aussage gemacht werden. Ob die gebildeten phosphathaltigen Verbindungen in Gegenwart von vielen anderen Verbindungen überhaupt entstehen und unter den gewählten Bedingungen stabil sind, ist zu bezweifeln. Die elementare Frage nach der Synthese (und Aufreinigung zu den erforderlichen Konzentrationen) der in dieser Studie eingesetzten Ausgangsstoffe ist darüber hinaus völlig offen. Wir haben derzeit keine plausible Erklärung, woher diese kommen könnten.
Überhaupt scheint die Diskussion, ob Nukleinsäuren oder Stoffwechsel zuerst entstanden sind, das eigentliche Problem gar nicht im Fokus zu haben. Wir benötigen für die einfachsten bekannten lebenden Zellen beides und noch viel mehr! Und wir kennen derzeit weder für eine ungesteuerte Synthese von Nukleinsäuren noch für die Entstehung einfacher, vernetzter stoffwechselähnlicher Reaktionssysteme eine Erklärung, in der nur die bekannten Naturgesetze, ohne weitere – notwendige – Randbedingungen eine Rolle spielen. Eine Besprechung der Arbeit von Keller et al. auf der Internetseite eines populärwissenschaftlichen Journals (Osterkamp 2014) wird mit folgenden Worten eröffnet: „So viel ist klar: Leben ist nichts als eine kurze, regelmäßig aus sich selbst heraus wiederholte Phase geordneter chemischer Reaktionen auf engem Raum; diesen nennt man dann gewöhnlich ‚Lebewesen‘; im einfachsten Fall auch schlicht ‚Zelle‘.“ Mit derart stark reduktionistischen Konzepten werden „geordnete chemische Reaktionen“ als „Leben“ definiert. Das Explanandum2 wird auf diese Weise kurzerhand wegdefiniert – eine Vorgehensweise, mit der in den Naturwissenschaften kein Erkenntnisgewinn zu erwarten ist.
Anmerkungen
1 „In their recent work Keller et al. (2014) observe an enzyme-free, metabolism-like reaction network under conditions reproducing a possible prebiotic environment.“
2 Das zu Erklärende
Literatur
Keller MA, Turchin AV & Ralser M (2014) Non-enzymatic glycolysis and pentose phosphate pathwy-like reactions in a plausible Archean ocean. Mol. Syst. Biol. 10, 725; DOI: 10.1002/msb.20145228.
Luisi PL (2014) Prebiotic metabolic networks? Mol. Syst. Biol. 10, 729; DOI 10.1002/msb.20145351.
Osterkamp J (2014) Das Henne-Ei-Problem von der Entstehung des Lebens. http://www.spektrum.de/alias/chemische-evolution/das-henne-ei-problem-von-der-entstehung-des-lebens/1283602.
Autor dieser News: Harald Binder
© 2014, http://www.genesisnet.info/schoepfung_evolution/n211.php
Zurück zur Artikel-Übersicht: https://www.wort-und-wissen.org/publikationen/genesisnet/
12.01.12 Frühe Erdatmosphäre – ungünstige Bedingungen für chemische Synthesen
Wie unter mutmaßlichen Bedingungen einer hypothetischen frühen Erde Leben entstehen konnte, ist unbekannt (vgl. z. B. Entstehung von Proteinen, https://www.genesisnet.info/index.php?Artikel=42061&Sprache=de&l=1 oder Entstehung von Nukleinsäuren, https://www.genesisnet.info/index.php?Artikel=42062&Sprache=de&l=1). Nun scheint sich herauszustellen, dass dafür auch keine geeigneten Atmosphären-Bedingungen geherrscht haben.
In den derzeit diskutierten Modellen über die Zusammensetzung der Atmosphäre auf der frühen Erde gehen die meisten Wissenschaftler davon aus, dass die Gaszusammensetzung vor über 4 Milliarden Jahren hauptsächlich von Gasen beeinflusst war, die durch vulkanische Aktivität aus dem Erdinnern in die Atmosphäre gelangten (Kasting 1993). Für die Szenarien zur Lebensentstehung und die Synthesereaktionen der dafür notwenigen Moleküle hat die Zusammensetzung der Erdatmosphäre großen Einfluss.
Die Herausforderung besteht nun darin, Daten zu finden, anhand deren die Vorstellungen über die Zusammensetzung der Erdatmosphäre getestet werden können. Als sehr alte geologische Proben kennt man Mineralien, die als Zirkon (Zirkonsilikat, ZrSiO4) bezeichnet werden. Dieses Mineral ist in abkühlendem Magma auskristallisiert. Dabei wurden auch andere Elemente in den Kristall eingebaut. Die ältesten Zirkonkristalle werden auf ca. 4,4 Milliarden Jahre datiert. Trail et al. (2011) haben das Element Cer in diesen alten Zirkonkristallen untersucht. Das Seltenerdenmetall Cer kommt in verschiedenen Oxidationsstufen vor (Ce3+ und Ce4+) und das Verhältnis dieser beiden Formen könnte Auskunft darüber geben, wie die Redox-Bedingungen zur Zeit der Kristallbildung waren. Um dies herauszufinden haben die Autoren im Labor Zirkonkristalle unter verschiedenen Oxidationsbedingungen gezüchtet.
Die Resultate ergaben, dass die Oxidationsbedingungen zur Zeit der Zirkonbildung vergleichbar mit den heutigen waren. Dies hätte zur Folge, dass in der Atmosphäre die für die Synthese von organischen Molekülen bedeutsamen Elemente Kohlenstoff (C), Wasserstoff (H), Stickstoff (N) und Schwefel (S) überwiegend als CO2, H2O, N2 und SO2 vorliegen, also in oxidierter Form.
Für die Experimente zur Simulation der Lebensentstehung (z. B. Ursuppen-Experimente von Miller) war man zunächst von einer reduzierenden Atmosphäre (CH4, H2, NH3) ausgegangen. Diese Ausgangsverbindungen würden die Synthesen von Aminosäuren und Bausteinen der Nukleinsäuren begünstigen. Selbst unter dermaßen günstigen hypothetischen Bedingungen konnte aber bisher die spontane Entstehung elementarer Biomoleküle nicht plausibel gemacht werden.
Neuere Befunde – wie auch die hier vorgestellten – deuten nun darauf hin, dass die Bedingungen noch ungünstiger waren als ursprünglich gedacht. Einer der Autoren formulierte das in einem Gespräch folgendermaßen: „Wir können nun mit einiger Sicherheit sagen, dass viele Wissenschaftler, die die Entstehung des Lebens auf der Erde erforschen, einfach die falsche Atmosphäre ausgewählt haben.“1
Die Untersuchungen von Trail et al. (2011) liefern nur Anhaltspunkte über die Redox-Bedingungen zur Zeit der Bildung der Zirkonkristalle, über den Sauerstoffanteil in der Atmosphäre geben sie keine Auskunft.
Vergleiche auch Hypothesen zur Uratmosphäre, https://www.genesisnet.info/index.php?Artikel=42041&Sprache=de&l=1.
Literatur
Kasting JF (1993) Earth’s early atmosphere. Science 259, 920-926.
Trail D, Watson EB & Tailby ND (2011) The oxodation state of Hadean magmas and implications for early earth´s atmosphere. Nature 480, 79-82.
Anmerkung
1 „We can now say with some certainty that many scientists studying the origins of life on Earth simply picked the wrong atmosphere.“ (http://www.sciencedaily.com/releases/2011/11/111130141855.htm)
Autor dieser News: Harald Binder
© 2012, http://www.genesisnet.info/schoepfung_evolution/n180.php
Zurück zur Artikel-Übersicht: https://www.wort-und-wissen.org/publikationen/genesisnet/
04.04.11 Zur Problematik sehr alter Mikrofossilien
Fossilien dokumentieren Lebensspuren vergangener Erdzeitalter. Mit besonderem Engagement wird nach immer ältern Spuren von Organismen gefahndet. Einzelne Befunde werden durchaus kontrovers diskutiert. Nun hat ein Team von amerikanischen Geologen Untersuchungen vorgelegt, die nahe legt, dass es sich bei Mikrofossilien aus Australien mit einem angegebenen Alter von ca. 3,5 Milliarden Jahren um Pseudo-Mikrofossilien, also nicht um ehemalige Lebewesen handelt.
Vor mehr als 20 Jahren beschrieben Schopf & Parker (1988) Mikrofossilien in der Apex Chert Formation in Australien. Die Autoren hatten anhand von Dünnschliffen (300 µm) in dem silikatreichen Gestein (Chert; Hornstein) des Pilbara Kratons in Westaustralien Strukturen gefunden und vermutet, dass es sich bei diesen um fossile Cyanobakterien handeln könnte. Brasier, ein englischer Geologe und Lehrbuchautor („Microfossils“) stellte diese Interpretation der ältesten Fossilien aufgrund eigener Untersuchungen in Frage (Brasier et al. 2002). Während Schopf & Parker die Mikrofossilien ausschließlich in gerundeten Gesteinsbruchstücken (Klasten) fanden und diesen Befund als Hinweis auf flachmarines Milieu als Bildungsbedingungen für die Fossilien vermuten, führen Brasier et al. Hinweise für hydrothermale1 Umgebung an. Beide Autorenteams konnten übereinstimmend im Zusammenhang mit den undurchsichtigen Strukturen im Gestein mit Hilfe spektroskopischer Methoden (Raman-Spektroskopie) kohlenstoffhaltige Komponenten diagnostizieren. In der Interpretation der Befunde, darüber ob die Strukturen einen biogenen Ursprung haben, also von Lebewesen herrühren, konnte allerdings keine Übereinstimmung erzielt werden, und so entspannte sich eine anhaltende kontroverse Diskussion (s. Literaturangaben in Marshall et al. 2011, Binder 2005).
Nun haben sich Marshall et al. (2011) mit einer neuen Studie in die Diskussion eingeschaltet und sehr überzeugende Daten vorgelegt, die gegen eine Interpretation der Strukturen als Fossilien sprechen. Aus Proben, die die Autoren selbst gesammelt hatten, stellten sie sowohl 300 µm als auch 30 µm dicke Dünnschliffe für Untersuchungen her. Sie dokumentieren Erscheinungen, die denen in den älteren Arbeiten vergleichbar sind: die Mikrostrukturen sind rötlich bis dunkelbraun.
In den 30 µm Dünnschliffen erscheinen die Strukturen bei mikroskopischen Untersuchungen als Störungen, Brüche (fractures) im Gefüge, die teilweise mit einem hellen und teilweise mit dunklem Mineral gefüllt sind. Die 30 µm Dünnschliffe lassen unterschiedliche Kristallgrößen erkennen: 4-65 µm (durchschnittlich 17,3 µm) für die hellen und 0,3-6 µm (durchschnittlich 2,2 µm) für die dunklen Mineralien. In den 300 µm „Dünnschliffen“ verschwimmen die unterschiedlichen Kristalle und das Material erscheint amorph (gestaltlos).
Mit Hilfe von Raman-Spektroskopie identifizierten Marshall et al. das dunkle Material als Hämatit (ein Eisenoxidmineral: Fe2O3) und das helle als Quarz (Siliciumdioxid: SiO2). In den Untersuchungen, die der bisherigen Diskussion zugrunde lagen, waren die Mikrostrukturen mit Kohlenstoff(C)-haltigem Material in Verbindung gebracht worden (ebenfalls aufgrund von Resultaten mit Raman-Spektroskopie). Die Diskussion ging bisher vor allem darüber, ob der nachgewiesene C biogenen* oder anorganischen Ursprungs sei.
*biogen (= von Lebewesen stammend)
Marshall et al. halten fest, dass in der gesamten Matrix sowohl mit Hilfe der Raman-Spektroskopie als auch mit Synchrotron-Strahlung Kohlenstoff nachgewiesen werden kann, aber nicht in Verbindung mit den bisher als Mikrofossilien interpretierten Strukturen. Die Autoren bestreiten, dass in der bisherigen Diskussion genannte Kriterien für Mikrofossilien charakteristisch für diese seien und verweisen darauf, dass auch rein mineralogische Phänomene sich entsprechend äußern können. Allein das Kriterium, dass bei vollständiger Mineralisierung (permineralisation) die Zentren von Fossilien Hohlräume aufweisen, lassen sie gelten, was aber für die zur Debatte stehenden „Mikrofossilien“ nicht überzeugend nachgewiesen sei.
Marshall et al. (2011) halten andere Mikrofossilien aus dem frühen Archaikum von Südafrika2 für glaubwürdiger und stellen Lebewesen in dieser Zeit nicht in Frage, ja sie sehen auch in dem diffusen Kohlenstoff im Apex Chert von Australien einen Hinweis auf Lebensformen, deren Struktur allerdings nicht fossil überliefert ist. Die Autoren weisen zurecht darauf hin, dass man sowohl die strukturellen Daten als auch die chemischen Analysen gerade im Blick auf sehr alte „Fossilien“ sehr nüchtern und kritisch beleuchten sollte, um falsche positive Meldungen zu vermeiden (s. Binder 2005).
In einem Überblicksartikel fassen Schopf et al. (2007) Arbeiten zusammen, in denen 48 Fundstellen von Stromatoliten und 14 Fundstellen von Mikrofossilien aus dem Archaikum (> 2500 Millionen Jahre) beschrieben werden. Sie kommen zu dem Schluss, dass auch wenn einige dieser Befunde kontrovers diskutiert werden, erste Lebensspuren aus dieser Epoche mit einem Alter von ca. 3,5 Milliarden Jahren gut begründet sind.
Die naturwissenschaftlichen Befunde zu fossilen Überlieferungen frühester Lebensformen werden also auch zukünftig von kontroversen Diskussionen begleitet bleiben.
Anmerkungen
1 Hydrothermal: unter hydrothermalen Bedingungen versteht man den Sachverhalt, dass Wasser unter erhöhtem Druck auch bei Temperaturen weit über 100° C in flüssigem Aggregatzustand vorkommt (bis zum kritischen Punkt bei 374,15°C). Unter diesen Umständen kann Wasser viele Stoffe, z. B. Mineralien lösen, die bei niedrigeren Temperaturen nicht oder nicht in derselben Menge löslich sind. Beispiele für hydrothermale Quellen sind die schwarzen oder weißen Raucher in der Nähe der mittelozeanischen Rücken.
2 Aus der Onverwacht Group, Barberton Mountain Land, Südafrika, deren Alter mit ca. 3,5 Milliarden Jahren angegeben wird (Literaturangaben s. Marshall et al. 2011 und Binder 2005)
Literatur
Binder H (2005) Anhaltender Streit um älteste Lebensspuren. Stud. Int. J. 12, 92-93.
Brasier MD, Green OR, Jephcoat AP, Kleppe AK, van Kranendonk MJ, Lindsay JF, Steel A & Grassineau NV (2002) Questioning the evidence for earth´s oldest fossils. Nature 416, 76-81.
Marshall CP, Emry & Marshall AO (2011) Haematite pseudomicrofossils present in the 3,5-billion-year-old Apex Chert. Nature Geosci. doi: 10.1038/NGEO1084
Schopf JW & Parker BM (1988) Early Archeans (3,3 billion to 3,5 billion years old) microfossils from Warrawoona Group, Australa. Science 237, 70-73.
Schopf JW, Kudryavtsev AB, Czaja AD & Tripathi AB (2007) Evidence of Archean life: Stromatolites and microfossils. Precambrian. Res. 158, 141-155.
Autor dieser News: Harald Binder
© 2011, http://www.genesisnet.info/schoepfung_evolution/n164.php
Zurück zur Artikel-Übersicht: https://www.wort-und-wissen.org/publikationen/genesisnet/
24.03.11 Millers Simulationsexperimente erneut unter der Lupe
Stanley L. Miller, Chemiker, der die berühmten Ursuppen-Experimente durchgeführt hat um zu demonstrieren, wie chemische Bestandteile von biologischen Zellen entstanden sein könnten, hat mit weiteren Simulationen experimentiert, die er sorgfältig protokolliert, aber nicht veröffentlicht hat. Nun haben Chemiker die Originalproben aus Millers Experimenten mit modernen Analysenmethoden untersucht und deren Ergebnisse veröffentlicht. Dabei werden die bekannten Ergebnisse bestätigt, aber auch die Probleme, die die synthetisierten Produktgemische für nachfolgende Peptidsynthesen hervorrufen.
Stanley S. Miller gilt als der Chemiker, der als Pionier Mitte des 20. Jahrhunderts erste experimentelle Untersuchungen zur Chemie der Lebensentstehung angestellt hat. Er veröffentlichte 1953 eine Aufsehen erregende und bis heute unverändert populäre Arbeit, in der er in eindrucksvoller Weise demonstrierte, dass man im Labor aus einem einfachen Gasgemisch Aminosäuren, die Bausteine für Proteine synthetisieren kann. Miller, der im Mai 2007 im Alter von 77 Jahren gestorben ist, hat sich lebenslang mit den Fragen des chemischen Ursprungs von Leben beschäftigt. Auch wenn er hinsichtlich einer naturwissenschaftlichen Klärung dieser Frage optimistisch war, so hat er doch gleichzeitig nüchtern und kritisch die bislang vorgeschlagenen Szenarien analysiert und kommentiert.
Jeffrey L. Bada – ehemaliger Schüler von Miller und heute Professor für Marine Chemie an der Scripps Institution of Oceanography der University of San Diego – beschäftigt sich ebenfalls mit Aminosäuren und deren Beiträgen in Modellen zur Lebensentstehung.
Nach dem Tod von Miller fanden Bada und Mitarbeiter Probengefäße aus dessen Ursuppen-Experimenten. Anhand von Millers Protokollen konnten sie die Proben entsprechenden Experimenten zuordnen und haben diese mit modernen Analysenmethoden erneut untersucht. Aus Experimenten aus den Jahren 1953-54 hatte Miller (1955) fünf Aminosäuren und verschiedene Substanzen, die er nicht identifiziert hatte (Papierchromatographie), beschrieben.
Johnson et al. (2008) identifizierten in Proben 22 Aminosäuren (neben vielen nicht proteinogenen* Aminosäuren auch Glycin, Alanin, Serin, Asparaginsäure, Valin, Glutaminsäure und Phenylalanin) und fünf Aminoverbindungen. Sie zeigten damit, dass die klassischen Ursuppen-Experimente hinsichtlich der Vielfalt an gebildeten Aminosäuren ergiebiger waren, als Miller dies erkennen konnte, aber auch, dass viele Verbindungen entstehen, die hinsichtlich biologischer Funktionen keine erkennbare Bedeutung haben oder für die Bildung von Peptiden hinderlich sind.
*proteinogen (= in heutigen Proteinen vorkommend)
Bada und ein Team von Mitarbeitern veröffentlichten nun erneut Analysenergebnisse von Proben aus Millers Simulationsexperimenten, die dieser 1958 durchgeführt, aber nie veröffentlicht hatte (Parker et al. 2011). Aus einem Gasgemisch bestehend aus Methan (CH4), Ammoniak (NH3), Schwefelwasserstoff (H2S) und Kohlendioxid (CO2) hatte Miller in einer modifizierten Miller-Apparatur (im Vergleich zur Originalapparatur war eine konisch zulaufende Glasspitze als Düse vor dem eigentlichen Reaktionsraum eingebaut: Glaskolben mit eingeschmolzenen Elektroden) Simulationsexperimente unter besonderer Berücksichtigung von Vulkanausbrüchen durchgeführt.
Insgesamt konnten Parker et al. 23 Aminosäuren und vier Aminoverbindungen identifizieren. Dabei enthielten 6 der Aminosäuren Schwefel (S) ebenso wie eine der Aminoverbindungen. Bei den nachgewiesenen 6 S-haltigen Aminosäuren handelt es sich nicht um solche, die am Aufbau von Proteinen beteiligt sind. Die Aminosäuren waren aus 2 bis 6 C-Atomen aufgebaut und alle, sowohl die proteinogenen als auch die anderen Aminosäuren waren racemisch, d. h., die spiegelbildlichen Isomere waren innerhalb der Messgenauigkeit im Verhältnis 1:1 vorhanden (D/L = 1 ± 10%). Diesen Befund werten die Autoren auch als Hinweis darauf, dass die Proben während der Lagerung nicht oder höchstens in Spuren verunreinigt wurden (zumindest nicht durch Verunreinigungen biologischen Ursprungs). Cystein, die einzige S-enthaltende Aminosäure, die in Proteinen vorkommt, konnte nicht nachgewiesen werden, oxidierte verwandte Verbindungen dagegen sehr wohl. Die Autoren spekulieren deshalb darüber, dass Cystein möglicherweise ursprünglich bei diesen Experimenten produziert worden war, aber während der Lagerung (ohne Schutz vor Oxidation) chemisch verändert worden ist.
Die Autoren diskutieren die mögliche Bedeutung von Vulkanen, die in der Erdgeschichte zumindest lokal und für gewisse Zeit reduzierende Gasmischungen einschließlich Schwefelwasserstoff produziert haben könnten.
Im Vergleich zu den anderen klassischen Simulationsexperimenten von Miller ist die Vielfalt an Aminosäuren größer (die proteinogenen Aminosäuren Threonin, Leucin und Isoleucin werden dort nicht beschrieben). Die Ausbeute an Aminosäuren ist in dem Experiment mit Schwefelwasserstoff (H2S) – vor allem bei den nicht proteinogenen Aminosäuren – im Vergleich zu den anderen Experimenten größer.
Parker et al. (2011) vergleichen die Verteilung der Aminosäuren und deren relative Häufigkeit in den von ihnen untersuchten Proben mit Analysendaten von kohligen Chondriten, der häufigsten Klasse von Meteoriten, die – wie die Bezeichnung andeutet – C-haltige Verbindungen aufweisen.
Solche Vergleiche hatte bereits Miller (Wolman et al. 1972) angestellt. Die zumindest teilweise vorhandene Ähnlichkeit nehmen die Autoren zu Anlass über vergleichbare Synthesebedingungen im interstellaren Raum bzw. an den Herkunftsorten der Meteoriten und in den Simulationsexperimenten, sowie über die Bedeutung der Gegenwart von H2S bei der Synthese von Aminosäuren zu spekulieren.
Mit dieser späten Analyse, Auswertung und Publikation von Millers Simulationsexperimenten ist dokumentiert, dass Stanley Miller dabei erstmals die Synthese von S-haltigen Aminosäuren gelungen ist.
Damit ist die Vielfalt an Aminosäuren, die in Simulationsexperimenten zur präbiotischen Chemie größer als bisher bekannt. Sie weicht aber auch deutlicher vom Spektrum der proteinogenen Aminosäuren ab. Die Untersuchungen bestätigen gleichzeitig die Probleme auf dem Weg zu biologisch aktiven Peptiden und Proteinen (Junker & Scherer 2006, Kapitel IV.7; Binder 2003). Im Blick auf deren Synthese stellen die bisher bekannten Resultate der Simulationsexperimente nach wie vor eine Sackgasse dar. Mit anderen Worten, die Herkunft biologisch aktiver Peptide für erste biologische Systeme (Zellen) ist bisher unbekannt.
Literatur
Binder H (2003) Miller-Experimente zur Chemie der Lebensentstehung – 50 Jahre danach. Stud. Int. J. 10, 65-73.
Johnson AP, Cleaves HJ, Dworkin JP, Glavin DP, Lazcano A & Bada JL (2008) The Miller vulcanic spark discharge experiment. Science 322, 404.
Junker R & Scherer S (2006) Evolution ein kritisches Lehrbuch. Gießen.
Miller SL (1955) Production of some organic compounds under possible primitive earth conditions. J. Am. Chem. Soc. 77, 2351-2361.
Parker ET, Cleaves HJ, Dworkin JP, Glavin DP, Callahan M, Aubrey A, Lazcano A & Bada JL (2011) Primordial synthesis of amines and amino acids in a 1958 Miller H2S-rich spark discharge experiment. Proc. Nat. Acad. Sci. USA; doi/10.1073/pnas.1019191108.
Wolman Y, Haverland WJ, Miller SL (1972) Nonprotein amino acids from spark discharges and their comparison with the Murchison meteorite amino acids. Proc. Natl. Acad. Sci. USA 69, 809-811.
Autor dieser News: Harald Binder
© 2011, http://www.genesisnet.info/schoepfung_evolution/n163.php
Zurück zur Artikel-Übersicht: https://www.wort-und-wissen.org/publikationen/genesisnet/
17.06.10 Künstliche Zellen – oder wurde gar Leben erzeugt?
Ende Mai dieses Jahres erregte eine Veröffentlichung von J. C. Venter und einem umfangreichen Team aus seinen Instituten großes Aufsehen (Sciencexpress: doi 10.1126/science.1190719). Die Wissenschaftler beschrieben darin den erfolgreichen Versuch, ein konstruiertes, im Labor erzeugtes Erbgut (DNA) in Bakterien einzubauen, so dass deren Eigenschaften von der künstlichen DNA geprägt werden. Venters Arbeiten werden in diesem Newsbeitrag beschrieben und bewertet.
Nachdem die Forscher zunächst das Erbgut von Mycoplasma-Bakterien (Mycoplasma genitalium 1995; später weitere Arten) analysiert und sequenziert hatten, haben sie in den vergangenen Jahren Methoden entwickelt, um nicht nur einzelne Gene herzustellen, sondern das gesamte Erbgut (Genom) im Labor zu erzeugen. Dazu haben sie auch E. coli-Bakterien und Hefezellen benutzt. Mit erheblichem technischem Aufwand kann man DNA-Fragmente mit einer vorgegebenen Sequenz von der Länge von ca. tausend Nukleotiden (Basenpaare, bp) synthetisieren. Diese Bausteine wurden von einer Firma industriell gefertigt. Das Genom von Mycoplasma mycoides umfasst allerdings mehr als 1 Million bp. Um ein Genom dieser Größe herzustellen nutzten die Autoren E. coli-Bakterien und veränderte Hefezellen. In mehreren Durchgängen konnten sie so größere DNA-Konstrukte aus 10 000 bp, 100 000 bp und schließlich das gesamte Genom mit 1 077 947 bp herstellen. Das künstliche Genom, das weitgehend dem natürlichen Vorbild nachgebaut worden war, enthielt auch Abschnitte, die als „Wasserzeichen“ dienten, und weitere Gene zur Selektion und Identifizierung des semisynthetischen Genoms.
Nun wurde das nachgebaute M. mycoides-Genom in die Zellen eines nahe verwandten Bakteriums (Mycoplama capricolum) verpflanzt. Die Autoren konnten nachweisen, dass unter den ausgewählten Bedingungen M. capricolum-Kulturen wuchsen, die sich unter dem Einfluss des M. mycoides-Genoms wie M. mycoides verhielten.
Die einzelnen Schritte dieses Projekts waren über Jahre entwickelt worden, dabei wurde eine Vielzahl neuer Methoden etabliert und eine Fülle von Problemen musste überwunden und gelöst werden. In dieser jüngsten Veröffentlichung sind nun alle diese Schritte in einem Projekt mit dem derzeit umfangreichsten künstlich hergestellten Genom durchgeführt worden. Das stellt eine ungeheure innovative technische Leistung dar und zeigt die Spitze dessen, was mit großem Aufwand heute im Labor machbar ist.
Qualitätskontrolle. Die Autoren beschreiben ein Detail, das die Herausforderungen, die bei einem solchen Projekt auftreten, erahnen lässt. Die Synthese des Genoms muss fortlaufend mit einer leistungsfähigen Qualitätskontrolle gekoppelt sein. Das Projekt war mehrere Wochen blockiert, da eine einzige Base (in einem Genom von mehr als einer Million bp!) in einem essentiellen Gen fehlte. Diese eine Base machte das gesamte Genom inaktiv, d. h. es konnte nicht erfolgreich in Empfängerzellen übertragen werden.
Mit diesem Projekt wurde nun nicht nur ein Organismus gentechnisch manipuliert, indem ein bzw. wenige Gene verändert wurden, sondern hier wurde ein komplettes Genom im Labor hergestellt und dann in eine (lebendige!) Empfängerzelle übertragen und zwar unter Bedingungen, die diese Zelle dazu veranlassen, das neue, semisynthetische Genom zu aktivieren. Dies wurde z. B. dadurch demonstriert, dass man die gesamten Proteine (Proteom), die die Zellen biosynthetisch herstellen, bei beiden Bakterienarten mit einander verglichen hat. Die M. capricolum-Zellen mit dem künstlichen Erbgut zeigten tatsächlich das für M. mycoides typische Proteom-Muster.
Wie ist diese Arbeit zu bewerten? Zuerst muss die technisch innovative Leistung der Autoren nochmals betont und anerkannt werden, mit der die Autoren die Biotechnologie in verschiedenen Bereichen vorangetrieben und damit neue Dimensionen eröffnet haben. Andererseits ist schon die Frage, ob es sich bei dem künstlichen M. mycoides-Genom um ein „synthetisches“ handelt, differenziert zu beantworten. Man kann derzeit ein Genom selbst dieser für Lebewesen bescheidenen Größe von ca. einer Million bp nicht allein durch chemische Synthese herstellen. Für den Zusammenbau der synthetisierten Fragmente wurden lebende Kulturen von E. coli und modifizierten Hefezellen eingesetzt.
Des Weiteren sind die Empfängerzellen selbst lebendig, sie werden nur in einem bisher ungeahnten Umfang manipuliert (indem ihr Genom gegen ein anderes, künstlich hergestelltes ausgetauscht wird). Das Ergebnis fordert unsere etablierten Vorstellungen von Lebewesen heraus, wenn man ein Bakterium durch die Einführung eines anderen Genoms in Bakterien eines anderen Stamms umwandeln kann. Die Autoren betonen zwar, dass mit ihrer Arbeit gezeigt worden sei, dass man Zellen konstruieren könne, indem man ihr Genom im Computer entwirft. Diese Aussage ist insofern einzuschränken, als das in der Arbeit hergestellte Genom weitestgehend (!) dem natürlichen Vorbild des M. mycoides-Genom entspricht. Um Genome selbst zu entwerfen zu können, verstehen wir eine lebende Zelle noch viel zu wenig und wissen wir zu wenig darüber.
Venter und seine Mitarbeiter bezeichnen die von ihnen erzeugten Bakterien als „synthetische Zellen“. Dieser Anspruch erscheint nicht gerechtfertigt und irreführend. Das biochemisch erzeugte Proteinmuster der Zellen ist zwar durch das künstliche Genom bestimmt und nach mehr als 30 Zellteilungen sind praktisch keine Proteine der ursprünglichen Empfängerzelle mehr vorhanden. Der Begriff „synthetische Zellen“ spiegelt jedoch eine extrem stark reduktionistische Betrachtungsweise wieder, die davon ausgeht, dass das Genom das Wesentliche einer lebenden Zelle darstellt. Das ist zwar ein äußert populärer Gedanke, aber zum jetzigen Zeitpunkt alles andere als erwiesen. Die gesamte biochemische Grundausstattung der Empfängerzelle bringt diese mit und ohne diese wäre eine erfolgreiche Genom-Transplantation nicht erfolgreich durchzuführen. Leben hat Venter also nicht erschaffen, sondern Teile von Lebewesen als Vorlage genutzt und nachgebaut sowie sich des Lebens selbst bedient, um die so synthetisierten Bausteine erfolgreich zu verknüpfen.
Literatur
Gibson DG, Glass JI, Lartigue C, Noskov VN, Chuang R-Y, Algire MA, Benders GA, Montague MG, Ma L, Moodie MM, Merryman C, Vashee S, Krishnakumar R, Assad-Garcia N, Andrews-Pfannkoch C, Denisova EA, Young L, Qi Z-Q, Segall-Shapiro TH, Calvey CH, Parmar PP, Hutchinson III CA, Smith HO & Venter JC (2010) Creation of a bacterial cell controlled by a chemically synthesized genome. Science, doi: 10.1126/science.1190719.
Autor dieser News: Harald Binder
© 2010, http://www.genesisnet.info/schoepfung_evolution/n152.php
Zurück zur Artikel-Übersicht: https://www.wort-und-wissen.org/publikationen/genesisnet/
25.09.09 Neue Impulse für die präbiotische Synthese von Pyrimidin-Nukleotiden
Englische Chemiker haben eine neue Idee vorgestellt, wie erste Bausteine von Nukleinsäuren präbiotisch, d.h. ohne die heute bekannte Biochemie entstanden sein könnten. Ihre Versuche, Nukleotide zu synthetisieren, folgen neuen Konzepten und zeigen interessante Reaktionsverläufe. Aber bei allen überraschend günstigen Syntheseschritten bleibt das Problem, dass für die chemischen Reaktionen reine Ausgangsstoffe verwendet werden und Randbedingungen, wie pH-Wert, Temperaturen und Reaktionszeit geregelt werden müssen. Damit müssen bei allem Optimismus, den diese Veröffentlichungen hervorgerufen haben, einige grundlegende Probleme für eine plausible Erklärung für die Entstehung erster Nukleinsäuren noch gelöst werden.
Nukleinsäuren in Form von DNS und RNS sowie deren Bausteine sind in allen bekannten Lebensformen von grundlegender Bedeutung, z. B. zur Repräsentation, Speicherung und Vermittlung der Erbinformation.
Trotz der Popularität der RNS-Welt-Hypothese (s. Artikel RNS-Welt, https://www.genesisnet.info/index.php?Artikel=42101&Sprache=de&l=1) erbrachten die Untersuchungen zur präbiotischen* Synthese von Nukleinsäuren bisher eher ernüchternde Resultate. Publikationen englischer Chemiker mit neuen Konzepten erregen umso mehr Aufsehen und verursachen manchen optimistischen Kommentar. Trotz einiger interessanter chemischer Details in den neuen Studien warten allerdings grundsätzliche Probleme der präbiotischen Chemie weiterhin darauf, gelöst zu werden.
*präbiotisch (= vor der Existenz von Leben)
Im Zusammenhang mit der chemischen Entstehung lebender Systeme müssen irgendwann erste Nukleinsäuren entstanden sein. Die bisherigen Vorschläge zur präbiotischen Synthese von Nukleinsäuren, d.h. ohne die Unterstützung durch die heute bekannte Biochemie, sind sehr ernüchternd. Der Anspruch an die Qualität und Reinheit der Ausgangsverbindungen, die komplexen, mehrstufigen Synthesereaktionen und die dabei notwendige feine Regulierung der Reaktionsbedingungen und -abläufe, lassen die bisherigen Modelle nicht als wirklich plausible Erklärungen erscheinen. Dabei ist die Frage nach der Information in Nukleinsäuren, wie wir sie aus den heutigen Organismen kennen, noch nicht einmal berührt.
Sutherland und Mitarbeiter haben in einer Reihe von Publikationen ein neues Konzept zur Synthese von Pyrimidin-Nukleotiden vorgestellt. Am Ausgangspunkt dieser Synthesen stehen Stoffe, deren Vorkommen im Weltraum spektroskopisch nachgewiesen worden ist, damit werden sie zu möglichen Kandidaten für präbiotische Reaktionen.
In bisherigen Konzepten wurde versucht, die N-Heterocyclen mit den separat synthetisierten Ribosezuckern zu verknüpfen und diese Verbindung dann mit Phosphatgruppen zu versehen. Powner et al. (2009) zeigen nun, dass es über bisher wenig beachtete Zwischenstufen möglich ist, Pyrimidin-Nukleotide direkt in Phosphatpuffer herzustellen (Details dazu s. Binder 2009).
Für die Plausibilität einer solchen Synthese unter präbiotischen Gesichtspunkten müssen jedoch u. a. auch folgende Fragen geklärt werden:
Wie kommen die Ausgangsstoffe in geeigneter Konzentration und Reinheit an den Reaktionsort? Wie verlaufen die Reaktionen in Gegenwart weiterer Chemikalien? Wie erfolgt die Regulation der Synthesen (pH-Wert, Temperatur, Reaktionszeit)?
Das von Powner et al. (2009) vorgestellte Synthesekonzept kann einen lang erhofften Impuls für die präbiotische Synthese von elementaren Molekülen zum Aufbau erster lebender Systeme liefern. Die chemische Erfahrung zeigt aber, dass auch bei den vorgestellten Synthesen „geeignete Bedingungen“ für erfolgreiche Reaktionen gewährleistet werden müssen. Dies schränkt die Plausibilität des Konzepts unter präbiotischen Bedingungen ein. Die von Vielen erhoffte Antwort für die Frage nach der Entstehung der ersten Nukleinsäuren konnten Powner et al. (noch) nicht geben, aber vielleicht eröffnen ihre Studien neue Denkwege und führen schließlich zu neuen Erkenntnissen.
Binder H (2009) Neue Synthese für Nukleinsäure-Bausteine – ein plausibler Weg zu ersten Nukleinsäuren? Studium Integrale Journal (in Vorb.)
Powner MW, Gerland B & Sutherland JD (2009) Synthesis of activated pyrimidine ribonucleotides in prebiotically plausible conditions. Nature 459, 239-242.
Autor dieser News: Harald Binder
© 2009, http://www.genesisnet.info/schoepfung_evolution/n136.php
Zurück zur Artikel-Übersicht: https://www.wort-und-wissen.org/publikationen/genesisnet/
22.04.09 Neues über die Entstehung biochemischer Komplexität
In Studium Integrale Journal (http://www.si-journal.de/index2.php?artikel=jg14/heft2/sij142-1.html) erschien im Oktober 2007 ein Artikel von Imming & Bertsch, der mehrere zuvor publizierte Arbeiten von Trevors, Abel, Voie und anderen umfassend rezensierte und kommentierte. Jene Aufsätze in verschiedenen anerkannten Journalen der Biochemie und Molekularbiologie hatten zum Ausdruck gebracht, dass die erstmalige Entstehung lebender Zellen nicht allein durch Zufall und Notwendigkeit erklärbar sei und die Biologie völlig anderer Denkansätze bedürfe, wenn sie der Beantwortung ihrer Ursprungsfragen näher kommen wolle. Tendenzen zur aktiven Unterstützung der „Intelligent Design“ Bewegung waren in den Publikationen nicht erkennbar. Ein ausdrückliches Ziel schien vielmehr zu sein, solche Bestrebungen durch neue biologische Erkenntnisse abzuwehren.
David Abel von der Origin of Life Foundation (Greenbelt, Maryland, USA) hat nun wiederum – dieses Mal im International Journal of Molecular Sciences – einen Artikel über ein ähnliches Thema veröffentlicht. Seine Schlussfolgerungen sind dieselben wie zuvor. Wir möchten an dieser Stelle keine ausführliche Rezension vorlegen, sondern nur den Inhalt grob wiedergeben und den Leser auf die Originalliteratur verweisen. Der Artikel von Abel nimmt seinerseits Bezug auf über 300 Publikationen, die zu einem erheblichen Teil erst in den letzten Jahren erschienen sind.
Abel erörtert zunächst bekannte Definitionen der Begriffe Komplexität, Ordnung und Struktur sowie deren Anwendung auf biologische Fragestellungen. Für einige dieser Begriffsbildungen ist die Informationstheorie von Shannon eine wichtige Grundlage, die um zusätzliche Aspekte wie etwa ein quantitatives Maß der Funktionalität von Sequenzen erweitert werden kann. Interessant – jedoch nicht neu – ist dabei, dass Ordnung als das Gegenteil von Komplexität aufgefasst werden kann. Weder Ordnung noch Komplexität garantieren allerdings so etwas wie Selbst-Organisation. Diese hat ganz andere Qualität.
„Organisation ist ungleich Ordnung. Disorganisation ist ungleich Unordnung. Selbst-Ordnung erfolgt spontan und alltäglich in der Natur ohne jegliche Organisation. Spontane, echte Selbst-Organisation wurde andererseits nie beobachtet“ (Abel 2009, 269).
Der Autor vertritt die Auffassung, dass Tausende von Publikationen über angebliche Selbstorganisation eigentlich Selbstordnung erörtern und damit die oft direkt oder indirekt einbezogene biologische Fragestellung nach dem Ursprung selbstorganisierter Systeme nicht beantworten können. Ein interessantes Zitat aus dem vorletzten Abschnitt ist das folgende: „Die Natur (physicality) kann nichts planen. Die Natur kann nicht Nützlichkeit gegenüber Nutzlosigkeit vorziehen. Sie kann nicht einmal Funktion von Funktionslosigkeit unterscheiden. Physikalische Dynamik allein ist blind gegenüber Nützlichkeit; und ihr ist es egal, ob irgend etwas im formalen Sinne funktioniert“ (S. 275).
Abel ist der Meinung, dass die Fähigkeiten nicht-linearer dynamischer Modellsysteme wie Fraktale, natürliche Attraktoren, chaotische Systeme, komplexe adaptive Systeme und so weiter völlig überschätzt werden. Es gibt nach bisheriger Erkenntnis keinen rein natürlich ablaufenden physikochemischen Mechanismus, der „programmieren“, also optimale Algorithmen, konfigurierte Schalter und integrierte Schaltkreise erzeugen kann. Abel warnt vor metaphysischer Überhöhung, die aus einem gewissen Wunschdenken folgt, alles in seiner Entstehung „natürlich erklären“ zu wollen. Wir schließen uns dieser Warnung vor einer metaphysischen Überhöhung von Naturvorgängen an: Die Natur steht nicht über sich selbst als ihr Schöpfer.
Wir möchten hinzufügen, dass die Beschäftigung mit den Naturprozessen immer mehr und immer deutlicher auf einen außer ihr liegenden Ursprung und Grund verweist, den wir mit dem Gott der Bibel identifizieren.
Weitergehende Überlegungen zu diesen Fragen finden sich bereits in dem genannten Artikel von Studium Integrale Journal (Imming & Bertsch 2007).
Literatur
Abel DL (2009) The capabilities of chaos and complexity. Int. J. Mol. Sci. 10, 247-291.
Abel DL, Trevors JT (2006) Self-organization vs. self-ordering events in life-origin models. Physics Life Rev., doi: 10.1016/j.plrev.2006.07.003
Dixon T (2001) A synthesis that failed. Science 294, 1467-1468.
Imming P & Bertsch E (2007) „Zufall und Notwendigkeit erklären den Ursprung des Lebens nicht.“ Stud. Int. J. 14, 55-65.
Voie ØA (2006) Biological function and the genetic code are interdependent. Chaos Solitons Fractals 28, 1000-1004.
(Der Artikel wurde zusammen mit Peter Imming verfasst)
Autor dieser News: Eberhard Bertsch
© 2009, http://www.genesisnet.info/schoepfung_evolution/n129.php
Zurück zur Artikel-Übersicht: https://www.wort-und-wissen.org/publikationen/genesisnet/
07.04.09 Ursprung der Homochiralität durch Meteoriten?
In biologischen Systemen weisen chemische Stoffgruppen wie Aminosäuren oder Kohlenhydrate von zwei spiegelbildlichen Strukturvarianten (Enantiomeren) fast ausschließlich nur die eine Form auf. Dieses Phänomen bezeichnet man als Homochiralität („gleichartige Händigkeit“, Imming 2006). So sind z. B. Proteine aus L-Aminosäuren aufgebaut. Würde man darin einzelne L-Aminosäuren durch deren Spiegelbilder (D-Aminosäuren) ersetzen, so wäre die dreidimensionale Faltung des Proteins gestört und damit würde auch die entsprechende Funktion verloren gehen. Wie kam es zur Festlegung auf L-Aminosäuren und D-Zucker oder worin liegt die Ursache für das Phänomen der Homochiralität? Diese Frage wird bereits seit vielen Jahren kontrovers diskutiert, ohne dass bisher überzeugende Vorschläge unterbreitet worden wären.
Die Chiralität könnte durch chemische Komponenten, die aus dem Kosmos auf die Erdoberfläche gelangen, bestimmt worden sein; so lautet ein bereits seit längerem diskutierter Vorschlag. Eine ganze Reihe von Untersuchungen von Meteoriten auf biologisch interessante Moleküle wurde vor diesem Hintergrund bereits veröffentlicht.
Pizzarello et al. (2003) hatten mittels Gaschromatographie verschiedene Bruchstücke des am 28. 9. 1969 in Victoria, Australien gefallenen Murchison-Meteoriten auf Aminosäuren untersucht. Dabei fanden sie für die Aminosäure Isovalin einen Überschuss an L-Isovalin von bis zu 15,2 % gegenüber D-Isovalin. Isovalin ist ein Isomer (Isomere: Moleküle gleicher Summenformel, die aber unterschiedliche Verknüpfungen und räumliche Anordnung aufweisen) zur in Proteinen vorkommenden (proteinogenen) Aminosäure Valin, eine Aminosäure mit 5 C-Atomen (Abb. 1).
Abb. 1: L-Valin und L-Isovalin
Man hat also auf einem Meteoritenfragment einen deutlichen Überschuss einer L-Aminosäure gegenüber deren D- Form gefunden. Die betreffende Aminosäure ist zwar nicht am Aufbau von Proteinen beteiligt, sie könnte aber, so wird spekuliert, irgendwie daran beteiligt sein, dass bevorzugt auch solche L-Aminosäuren synthetisiert werden, die in Proteinen der Lebewesen vorkommen. Verschiedene Bruchstücke des Meteoriten zeigten jedoch sehr unterschiedliche Verhältnisse (0-15 %).
Nun haben Glavin und Dworkin (2009) Fragmente des Murchison-Meteoriten und anderer Meteoriten auf die Verteilung von enantiomeren Aminosäuren mit einer anderen Methode (Flüssigkeitschromatographie) untersucht und dabei ebenfalls für die Aminosäure Isovalin einen deutlichen Überschuss des L-Enantiomeren von bis zu 18,5 % gefunden. Damit bestätigen sie die Resultate von Pizzarello et al. (2003) hinsichtlich des hohen Überschusses an L-Isovalin im Murchison-Meteoriten (18,5 %) und auch in einem zweiten, bisher noch nicht in dieser Hinsicht untersuchten Meteoriten (Orgueil; 1864 in Frankreich gefallen) weisen sie einen L-Isovalinüberschuss von 15,2 % nach.
Isovalin ist – wie bereits erwähnt – nicht am Aufbau von Proteinen beteiligt. Die proteinogene, isomere Aminosäure L-Valin kann durch Abspaltung des Protons am a-C-Atom (dort ist bei Isovalin eine Methylgruppe (-CH3)) in D-Valin umgewandelt werden; ein Vorgang, den man als Racemisierung bezeichnet.
Isovalin ist gegen Racemisierung vergleichsweise stabil, da die Bindung zur CH3-Gruppe sehr viel stabiler ist. Ausgehend von L-Enantiomeren erhält man also bei den proteinogenen Aminosäuren im Laufe der Zeit aufgrund von H-Abspaltung am a-C-Atom ein Gemisch aus 50 % L- und 50 % D-Aminosäure; diese 1:1 Mischung bezeichnet man als Racemat.
Wie kann also nun ein Überschuss an L-Isovalin in Bruchstücken von Meteoriten zustande kommen und erklärt werden? Eine Verunreinigung durch irdische Komponenten ist wenig wahrscheinlich, da Isovalin nur in geringen Konzentrationen in der Umgebung der Fundstelle nachzuweisen ist und auch generell auf der Erde eher selten vorkommt.
Die Autoren sehen einen Zusammenhang zwischen mineralogischer Zusammensetzung der Meteoriten (konkret deren Wassergehalt) und dem Überschuss an L-Isovalin. Sie schlagen keinen chemischen Mechanismus vor, sondern verweisen auf eine (auf vergleichsweise wenigen Daten basierende) Korrelation, wonach mit zunehmender mineralischer Veränderung durch Wasser der Überschuss an L-Isovalin steigt.
Dabei ist allerdings zu berücksichtigen, dass z. B. beim Murchison-Meteoriten (bei einer Fundmenge von ca. 100 kg) sowohl die mineralische Zusammensetzung als auch die organischen Komponenten nicht einheitlich sind, sondern große Heterogenität aufweisen.
Somit liegt durch die Arbeit von Glavin und Dworkin (2009) eine Bestätigung für zumindest gelegentliche Überschüsse von L-Aminosäuren in Meteoriten vor, ohne dass bisher deren Entstehung verstanden wäre. Bei den bisher vorgelegten Untersuchungen und Betrachtungen sind die extremen Bedingungen nicht berücksichtigt, denen die Meteoriten beim Eintritt in die Erdatmosphäre ausgesetzt sind und die typischerweise den größten Teil des Materials verdampfen lassen. Wie weit werden dadurch die mineralogische Zusammensetzung und die organischen Komponenten verändert? Waren die Bedingungen zur Zeit der hypothetischen frühen, noch unbelebten Erde vergleichbar?
Grundsätzlich können bei chemischen Synthesen in Gegenwart chiraler Komponenten Produkte erzeugt werden, die einen Enantiomerenüberschuss aufweisen. Wenn man gezielt bestimmte enantiomere Moleküle herstellen will, muss man chirale Information in das Reaktionssystem einbringen. Das könnte beispielsweise durch einen chiralen Katalysator geschehen, z. B. eine L-Aminosäure. Solche stereospezifischen Synthesen müssen erfahrungsgemäß sehr sorgfältig geplant werden und für gute Ausbeuten müssen die Randbedingungen optimal eingestellt sein.
Was bisher aus der Analyse von Meteoriten vorliegt, sind wiederholte Nachweise von Überschüssen von solchen L-Aminosäuren, die keine oder allenfalls geringe biologische Bedeutung haben. Um beurteilen zu können, ob dadurch ein Effekt auf die stereospezifische Synthese von biologisch bedeutsamen Komponenten erhofft werden kann, benötigen wir Einsicht in und Verständnis von kosmochemischen Prozessen und sehr viel mehr Daten. Auch die hier vorgestellten Arbeiten ändern nichts daran, dass wir derzeit keine naturalistische Erklärung für die Entstehung der Homochiralität haben (Imming 2006).
Literatur
Imming P (2006) Die fehlenden Spiegelbilder. Stud. Int. J. 13, 14-21.
Glavin DP & Dworkin JP (2009) Enrichment of the amino acid L-isovalin by aquious alteration on CI and CM meteorite parent bodies. Proc Nat. Acad. Sci USA.
Pizzarello S,Zolensky M, Turk KA (2003) Nonracemic isovaline in the Murchinson meteorite: chiral distribution and mineral association. Geochim. Cosmochim Acta 67, 1589-1595.
Autor dieser News: Harald Binder
© 2009, http://www.genesisnet.info/schoepfung_evolution/n127.php
Zurück zur Artikel-Übersicht: https://www.wort-und-wissen.org/publikationen/genesisnet/
11.02.09 „Fast lebendige Moleküle“
RNA-Moleküle – hohe Erwartungen für die Lebensentstehung
Zu Beginn des Jahres wurde in den Tagesmedien die jüngste Veröffentlichung von G.F. Joyce über Experimente mit RNA aufgenommen und mit Schlagzeilen versehen, die den Eindruck erwecken, es seien neue Erkenntnisse im Zusammenhang mit der Entstehung erster genetischer Information gewonnen worden. Da war z. B. zu lesen von „fast lebendigen Molekülen“, von „Evolution im Labor“ und davon, dass Forscher der Vision vom Leben im Reagenzglas einen Schritt näher gekommen seien.
Welche Experimente wurden für die Untersuchungen durchgeführt und wie können die Resultate interpretiert werden? Die Arbeit von Lincoln & Joyce (2009) ist Teil eines Projekts, in dem ein Reaktionssystem etabliert werden soll, in welchem RNA-Moleküle ihre eigene Synthese katalysieren* (Autokatalyse) und sich dadurch selbst vermehren.
*katalysieren (= eine Reaktion ermöglichen)
Autokatalytische RNA-Synthese. In ersten Ansätzen waren RNA-Moleküle mit enzymatischen Eigenschaften (synthetische Ribozyme) entwickelt worden. Für die Reaktion werden diese RNA-Moleküle (R) mit zwei kleineren RNA-Fragmenten (A und B) versetzt, die sich über Watson-Crick-Basenpaarung spezifisch zu einem Komplex RAB verbinden. In diesem Komplex werden die Fragmente A und B katalytisch miteinander verknüpft und so ein neues Ribozym synthetisiert (A + B -> R), so dass ein Komplex RR entsteht (Paul & Joyce 2002).
Weiterentwicklung des Reaktionssystems. Die Leistungsfähigkeit dieses Reaktionssystems war jedoch sehr eng begrenzt, die Verdopplungszeit betrug ca. 17 Stunden und es wurden nur zwei aufeinander folgende Verdopplungen erreicht. Dieses System wurde nun weiter entwickelt und eine höhere Leistungsfähigkeit erreicht. Lincoln & Joyce konzipierten ein verzweigtes Reaktionssystem, in dem das RNA-Enzym 1 nicht direkt seine eigene Synthese katalysierte, sondern aus den beiden Fragmenten A und B ein RNA-Molekül 2 herstellte, das seinerseits wieder aus den komplementären Fragmenten A’ und B’ die Produktion von RNA-Enzym 1 ermöglicht. Dieses Reaktionssystem war zunächst noch 10 mal langsamer im Vergleich zur ursprünglichen Anordnung. Durch gezielten Austausch bestimmter Nukleotide konnte deren Wirksamkeit jedoch optimiert werden (in vitro Evolution). Nun konnte eine stabile exponentielle Vermehrung nachgewiesen werden mit einer 25-fachen Vermehrung innerhalb von 5 Stunden bei 42 °C. Die Autoren konnten auch zeigen, dass wenn die für die Synthese benötigten RNA-Fragmente im Reaktionsgefäß erschöpft waren, weil sie nahezu vollständig für die Synthese verbraucht waren, man die Reaktion wieder neu initiieren kann, indem man einen Anteil der Reaktionsmischung (welche die synthetisierten RNA-Enzyme 1 und 2 enthält) zu einem neuen Ansatz aus den Fragmenten (A, A’, B und B’) gibt. Damit ist demonstriert, dass diese Reaktion läuft, solange die entsprechenden Fragmente vorhanden sind, und dass sie auch in aufeinander folgenden Schritten ausführbar ist.
Potential dieser RNA-Synthese. Durch den Austausch von Nukleotiden in bestimmten Bereichen der RNA-Moleküle konnten Lincoln & Joyce Varianten erzeugen, ohne deren Fähigkeit zur indirekten Selbstvermehrung wesentlich zu beeinträchtigen. Diese Varianten können im Experiment miteinander hinsichtlich ihrer Leistungsfähigkeit verglichen (Konkurrenz) und entsprechend selektiert werden.
Das von Joyce und seinen Mitarbeitern entwickelte gekoppelte autokatalytische Reaktionssystem ist hinsichtlich einer biotechnologischen Nutzung von großem Interesse. Die Autoren weisen darauf hin, dass man weitere enzymatische Funktionen integrieren und so Systeme mit höherer Komplexität etablieren kann, die dann durch gezielte Selektionskriterien für entsprechende Anwendungen optimiert werden können.
Lincoln & Joyce (2009) verweisen außerdem darauf, dass ihr Konzept durch weiteren Ausbau des Reaktionssystems die Möglichkeit zur Entdeckung neuer biochemischer Funktionen bietet. Sie halten es jedoch nicht für wahrscheinlich, dass dies auf der Erde seit der postulierten Etappe der RNA-Welt passiert sein könnte. Die Autoren begründen diese Vermutung zwar nicht ausdrücklich, aber fehlende Hinweise in der bekannten Molekularbiologie und der Aufwand, welcher zu Etablierung eines solchen Systems zu leisten ist, weisen sehr deutlich in diese Richtung.
Bewertung. Damit zeigen sie sehr nüchtern, dass solche chemischen Systeme auf der Basis von RNA-Molekülen zwar ein interessantes und innovatives Werkzeug in den Händen von Chemikern sind, dass aber – anders als das in manchen populären Darstellungen behauptet – in diesen RNA-Molekülen nicht (genetische) Information entsteht und vermehrt wird. Die Eigenschaften der verwendeten Komponenten wurden absichtsvoll entwickelt und für die Optimierungsprozesse (in vitro Evolution) die nötigen Randbedingungen sehr genau geplant und entsprechend eingestellt.
Im Blick auf die spontane Entstehung von RNA-Molekülen brachte Robert Shapiro, ein erfahrener (Nukleinsäure-) Chemiker folgende Analogie zum Ausdruck: „Das zentrale Problem lässt sich anhand einer Analogie erläutern: Nachdem ein Golfer einen 18-Loch-Kurs erfolgreich absolviert hat, behauptet er, der Ball hätte das auch ohne ihn schaffen können – unter der Einwirkung natürlicher Kräfte wie Erdbeben, Stürmen, Regengüssen und so weiter –, wenn man ihm nur genügend Zeit gelassen hätte. Ähnlich wie in diesem Vergleich widerspräche die spontane Entstehung von RNA keinem Naturgesetz; nur wäre sie extrem unwahrscheinlich gewesen“ (Shapiro 2007). (siehe auch „RNS-Welt und Replikation“, https://www.genesisnet.info/index.php?Artikel=42100&Sprache=de&l=1)
Lincoln & Joyce (2009) haben also die Weiterentwicklung eines sehr interessanten Synthesesystems für RNA-Moleküle vorgestellt. Die Erfahrungen mit diesem System zeigen aber deutlich, dass
- es sich um ein anspruchsvolles Laborsystem handelt, welches Chemie-know how und Kreativität von Chemikern voraussetzt,
- RNA-Moleküle synthetisiert werden können (und nur RNA!), solange die notwendigen Ausgangsstoffe und Reaktionsbedingungen gewährleistet sind,
- RNA-Moleküle hinsichtlich gewählter Kriterien optimiert werden können durch entsprechend geänderte Reaktionsbedingungen,
- neue Funktionen (von Chemikern) integriert werden müssen.
Mit dem Reaktionssystem konnte bisher kein Weg aufgezeigt werden, wie neue Funktionen (Information) generiert werden könnten. Wollte man ähnliche Reaktionen im Zusammenhang mit ungesteuerter (präbiotischer) Chemie diskutieren, müsste zuerst untersucht werden, ob sie in Gegenwart von Verunreinigungen, Nebenprodukten, … überhaupt nennenswerte Mengen an gewünschtem Produkt liefern.
Quellen
Lincoln TA & Joyce GF (2009) Self-sustained replication of an RNA enzyme. Science 10.1126/science.1167856
Paul N & Joyce GF (2002) A self-replicating ligase ribozyme. Proc. Nat. Acad. Sci USA 99, 12733-12740.
Shapiro R (2007) Ein einfacher Ursprung des Lebens. Spektrum der Wissenschaft (11) 64-72.
Autor dieser News: Harald Binder
© 2009, http://www.genesisnet.info/schoepfung_evolution/n123.php
Zurück zur Artikel-Übersicht: https://www.wort-und-wissen.org/publikationen/genesisnet/
09.07.08 Evolutionäre Entstehung von Holinen
Sind verschobene Leseraster ein Design-Signal?
Auf der Internetseite von „Evolution – ein kritisches Lehrbuch“ wurde kürzlich ein ausführlicher Artikel über „Hypothesen zur Evolution von Bakteriophagen-Holinen“ von Siegfried Scherer veröffentlicht (http://evolutionslehrbuch.wort-und-wissen.de/teil-7/kapitel-16-06/kapitel_16_6_2_zusatz.pdf; 23 Seiten, 15 Abb., 615 KB). Darin geht es unter anderem um die Frage, wie das Vorkommen verschiedener Leseraster im selben DNA-Abschnitt evolutionär entstanden sein könnte. In „Evolution – ein kritisches Lehrbuch“ wird eine solche Doppel- oder gar Mehrfachnutzung als mögliches „Design-Signal“ vorgestellt und behauptet, die evolutive Entstehung überlappender Gene sei unbekannt. In dem nun veröffentlichten ausführlichen Artikel zeigt Scherer, dass und warum diese Behauptung nach wie vor dem Stand des Wissens entspricht. Nachfolgend wird an dieser Stelle die Zusammenfassung wiedergegeben.
Zu diesem Beitrag wurde auch ein Interview mit dem Autor unter http://evolution-schoepfung.blogspot.com/2008/07/interview-von-christoph-heilig-mit.html veröffentlicht. Darin erklärt Scherer zunächst, worum es in dem Holine-Artikel geht, und geht dann auf schwerwiegende Anschuldigungen ein, die im Zusammenhang mit Abschnitt 16.6.2 „Überlappende Gene“ von „Evolution – ein kritisches Lehrbuch (https://www.wort-und-wissen.org/publikationen/lehrbuch/) an seine Adresse gerichtet wurden. Leser, die den Wissenschafts- und Publikationsbetrieb nicht kennen, erhalten durch dieses Interview wichtige Informationen, um selbst die Stichhaltigkeit dieser Vorwürfe einschätzen zu können. Auch als Einleitung zum Holine-Artikel ist die Lektüre dieses Interviews sehr zu empfehlen.
Zusammenfassung des Holine-Artikels: Bakteriophagen sind Viren, welche Bakterienzellen befallen und sich auf Kosten dieser Wirtszellen vermehren. Die Zelle wird am Ende des Infektionszyklus lysiert und die Bakteriophagen-Nachkommen werden freigesetzt. Die Lyse der Wirtszelle hängt häufig von einem Holinprotein ab, welches Läsionen in der Cytoplasma-Membran erzeugt. Durch diese „Löcher“ können zellwandlytische Endolysine des Bakteriophagen die Zellwand erreichen und zerstören, was dann zur schnellen Zelllyse führt. Holine sind eine diverse Gruppe von Membranproteinen mit mehr als 50 Familien, was als Beleg für eine einfache Evolvierbarkeit angesehen wurde. Allerdings sind Bakteriophagen auch hinsichtlich der anderen Proteine die diverseste Gruppe aller „Lebewesen“.
Sind natürliche Prozesse bekannt, welche eine Entstehung von Holinen plausibel erscheinen lassen? Und wie könnte man sich die Entstehung eines Holingens erklären, welches komplett in das Gen eines zellwandlytischen Proteins eingebettet ist, aber in einem anderen Leseraster („out-of-frame“) abgelesen wird? Am Beispiel bekannter Holinstrukturen wird eine phantasievolle evolutionäre Geschichte zur Entstehung dieser Proteine erzählt. Diese Geschichte wird dann anhand verfügbarer experimenteller Daten zur Struktur-Funktionsbeziehung von Holinen einem „reality check“ unterworfen. Dabei ergibt sich, dass die Wahrscheinlichkeit der Entstehung von Holinen durch bekannte biologische Prozesse sehr klein ist. Aufgrund von Datenmangel ist aber selbst eine semi-quantitative Abschätzung der Entstehungswahrscheinlichkeit nicht sinnvoll möglich. Deshalb kann derzeit nur festgestellt werden, dass man nicht weiß, wie ein Holin-Gen de novo entstanden sein könnte. Diese Schlussfolgerung gilt auch für das Holin-ähnliche Protein Hol187 des Staphylococcus aureus Phagen 187, das in einem anderen Leseraster innerhalb eines Gens völlig verschiedener Funktion codiert wird.
Die Erzählung einer evolutionären Geschichte zur Holin-Entstehung ist ein wichtiger Teil des wissenschaftlichen Erkenntnisprozesses, weil sie zur Konzeption von Experimenten führen kann, welche die Geschichte bestätigen oder zum Widerspruch führen. Die experimentelle Prüfung steht bezüglich der Holine noch weitgehend aus. Es liegt eine Wissenslücke der Evolutionsbiologie vor. Wissenslücken sind jedoch nicht geeignet, um die „Unmöglichkeit“ eines postulierten Evolutionsprozesses zu beweisen.
Autor dieser News: Studiengemeinschaft Wort und Wissen
© 2008, http://www.genesisnet.info/schoepfung_evolution/n116.php
Zurück zur Artikel-Übersicht: https://www.wort-und-wissen.org/publikationen/genesisnet/
02.06.07 Stanley L. Miller – Pionier der Ursuppenforschung gestorben
Am Sonntag, 20. Mai 2007 starb in einem Pflegeheim in der Nähe von San Diego der Chemiker Stanley Miller (* 7. März 1930). 1953 erschien in der Wissenschaftszeitschrift Science unter seinem Namen eine Aufsehen erregende Arbeit über die Herstellung von Aminosäuren unter präbiotischen (= vor der Existenz von Leben) Bedingungen. Mit dieser Arbeit betrat der junge Chemiker die wissenschaftliche Bühne und kann als Pionier der experimentellen Erforschung chemischer Prozesse zur Lebensentstehung gelten. Theoretische Überlegungen dazu hatten zuvor bereits der russische Biochemiker Alexander Oparin (1924), der britische Physiker John D. Bernal (1949) sowie der Nobelpreisträger und Doktorvater von Miller, Harold C. Urey (1952) veröffentlicht. Auch wenn sich die euphorischen Hoffnungen, die mit dieser und den nachfolgenden Veröffentlichungen von Miller verknüpft wurden, bis heute bei weitem nicht erfüllt haben, fanden sie doch große Resonanz in der wissenschaftlichen Diskussion und Eingang in Lehrbücher, in letzteren meist in sehr unkritischer Form.
In den Ursuppenexperimenten nach Miller entstehen in wässrigen Systemen aus einfachen Gasgemischen unter dem Einfluss unterschiedlicher Energiequellen komplexe Produktgemische, diese enthalten u.a. auch einige proteinogene (= in den Proteinen der Lebewesen vorkommende) Aminosäuren. Diese Befunde werden bis in die aktuellen Auflagen von Schul- und anderen Lehrbüchern zitiert und so dargestellt, als sei damit historisch der entscheidende Durchbruch zum Verständnis der Lebensentstehung gelungen.
Miller hat im Gegensatz zu vielen Lehrbuchautoren die experimentellen Untersuchungen zur Chemie der Lebensentstehung stets kompetent und nüchtern kritisch diskutiert. In Publikationen und Tagungsbeiträgen hat er immer wieder deutlich gemacht, dass die entscheidenden Fragen der Lebensentstehung nach wie vor offen sind und dass die 1953 geweckten Erwartungen bisher unerfüllt geblieben sind (Binder 2003). Die von ihm durchgeführte Synthese von Aminosäuren stellt auch in allen bis heute getesteten Varianten keine plausible Ausgangsbasis für die Entstehung von Oligo- oder Polypeptiden (= aus vielen Aminosäuren zusammengesetzte kettenförmige Verbindung) (Eiweiß) dar. Das wässrige System steht einer Kondensationsreaktion (= Verknüpfung der Aminosäuren unter Wasserabspaltung) entgegen und die monofunktionellen Bestandteile des Produktgemisches verhindern Polymerisationsreaktionen (Kettenbildung) sehr effektiv (Details siehe „Entstehung von Proteinen“, https://www.genesisnet.info/index.php?Artikel=42061&Sprache=de&l=1). Auch das Problem der Homochiralität (Imming 2006) von Biomakromolekülen ist nach wie vor ungelöst (siehe auch Kurzübersicht in „Die fehlenden Spiegelbilder“, https://www.genesisnet.info/index.php?Artikel=42081&Sprache=de&l=1).
Miller hat auch andere Lösungsansätze zur Frage der Lebensentstehung mit seinen Mitarbeitern kritisch geprüft und z. B. gezeigt, dass für die derzeit populäre RNA-Welt Hypothese die geringe chemische Stabilität der RNA-Bausteine ein derzeit noch ungelöstes Problem darstellt und einfachere Vorstufen notwendig macht (zur detaillierten Diskussion s. Junker & Scherer 2006 und Binder et al. 2007; siehe außerdem „RNS-Welt und Replikation“, https://www.genesisnet.info/index.php?Artikel=42100&Sprache=de&l=1).
Nach einem öffentlichkeitswirksamen Start seiner wissenschaftlichen Karriere hat Stanley Miller 1954 unter H. C. Urey an der University of Chicago seine Dissertation abgeschlossen. Er war nach den Zwischenstationen California Institute of Technology und Columbia University seit 1960 im Department of Chemistry der University of California, San Diego tätig. Neben anderen Auszeichnungen erhielt Miller 1983 nach C. Ponnamperuma (1980) als zweiter Preisträger die Oparin-Medaille der ISSOL – The International Astrobiology Society (früher: International Society for the Study of the Origin of Life). Die letzten Veröffentlichungen mit Stanley Miller als Autor erschienen 2000 (seit 1999 hat er mehrere Schlaganfälle erlitten).
Die von Stanley Miller mit ausgelöste und maßgeblich geprägte naturwissenschaftliche Erforschung der Lebensentstehung konnte bis heute die geweckten und hochgesteckten Erwartungen – in klarem Gegensatz zu vielen populären Darstellungen – nicht erfüllen. Miller ging es bei aller persönlichen Popularität in seinen Publikationen, Vorträgen und bei Diskussionen darum, dass in der Erforschung der Chemie der Lebensentstehung kompetent, gründlich und nüchtern gearbeitet wird. Er hat dazu wichtige Beiträge geleistet, und es bleibt zu wünschen, dass er in dieser Hinsicht für die zukünftige Arbeit Vorbild bleibt.
Literatur
Binder H (2003) Miller-Experimente zur Chemie der Lebensentstehung – 50 Jahre danach. Stud. Int. J. 10, 65-73. (online: http://www.si-journal.de/index2.php?artikel=jg10/heft2/sij102-3.html)
Binder H, Scherer S & Imming P (2007) Was ist über die Entstehung des Lebens bekannt? Religion – Staat – Gesellschaft 7 (2), 389-416.
Imming P (2006) Die fehlenden Spiegelbilder. Erklärungsversuche für das Phänomen der natürlichen Homochiralität. Stud. Int. J. 13, 14-21. (in ähnlicher Form online: „Die fehlenden Spiegelbilder“, https://www.genesisnet.info/index.php?Artikel=42081&Sprache=de&l=2)
Junker R & Scherer S (2006) Evolution – ein kritisches Lehrbuch. 6. Aufl. Gießen, Kapitel IV.7.
Autor dieser News: Harald Binder
© 2007, http://www.genesisnet.info/schoepfung_evolution/n84.php
Zurück zur Artikel-Übersicht: https://www.wort-und-wissen.org/publikationen/genesisnet/
10.04.07 Artikel über Chiralität: Wurde wichtige neuere Literatur unterschlagen?
Im Internet erschien vor kurzem eine Kritik an der Interessierten-Version des Artikels „Die fehlenden Spiegelbilder“ von Peter Imming. Die Kritik lautete:
„So werden neuere Erklärungsansätze bezüglich des ‘Chiralitätsproblems’ (wie etwa die bevorzugte Anreicherung eines bestimmten Stereoisomers an Mineralien oder die Möglichkeit eines auf ‘enantiomerreine’ Proteine oder homochirale Nucleinsäuren zusteuernden Selektionsprozesses, der aus Stabilitätsgründen alle ‘Mischvarianten’ aus dem Rennen wirft) in dem Artikel von Imming (s. Die fehlenden Spiegelbilder, https://www.genesisnet.info/index.php?Artikel=42081&Sprache=de&l=1) gar nicht erwähnt, und die am Textende allen Ernstes angebotene ‘Erklärung’, irgendein Schöpfer habe das Enantiomerengemisch irgendwie ‘manipuliert’ (!), ist unter wissenschaftslogischen Gesichtspunkten geradezu haarsträubend.“ (Dr. A. Beyer auf http://www.evolutionsbiologen.de/loennig_witten2.html, Stand: 27. 3. 2007)
Dazu ist zu sagen:
- Die Anreicherung von Stereoisomeren an Mineralien ist kein „neuerer“ Erklärungsansatz, sondern wurde bereits 1975 diskutiert (z. B. Bonner WA et al. (1975) Asymmetric adsorption by quartz: A model for the prebiotic origin of optical activity. Origin Life 6, 367-376). Der Kritiker hat offenbar die Expertenversion des Artikels nicht oder zu flüchtig gelesen: Im Abschnitt „Spontaner Symmetriebruch“ wird genau darauf eingegangen (siehe „Bevorzugte Adsorption eines Enantiomers an eine chirale Oberfläche (z. B. an Calcit- oder Quarzkristalle)“ usw.).
- Genausowenig „neu“ ist der Gedanke eines „Selektions“prozesses bei Proteinen und Nukleinsäuren (z. B. für Peptide: Blair NE & Bonner WA (1981) A model for the enantiomeric enrichment of polypeptides on the primitive Earth. Origins Life 11, 331-335). In der Expertenversion von „Die fehlenden Spiegelbilder“ (Die fehlenden Spiegelbilder) wird mit der folgenden Passage darauf eingegangen: „Präbiotisch besteht keine Konkurrenz von Molekülen, und in einer achiralen Umgebung hat kein Enantiomer einen Vorteil gegenüber einem anderen. Das auf biologischer Ebene wichtige Konkurrenz-Konzept gilt hier nicht. Wenn zum Beispiel behauptet wird, die alpha-Helix eines enantiomerenreinen Proteins habe den Vorteil, weniger leicht hydrolysiert zu werden, so gilt dasselbe für das ebenso existenzfähige Spiegelbild dieser alpha-Helix, die aus den spiegelbildlichen Aminosäuren zusammengesetzt ist.“ Wie unter 1. in dieser Replik ist das Phänomen der Homochiralität in seinem Ursprung nicht erklärt, sondern auf ein anderes Beispiel verschoben.
- Auch neueste Fachliteratur sagt klar, dass es einen akzeptierten Mechanismus für die Entstehung der Homochiralität nicht gibt. Beispiel: „Warum benutzen Organismen nur L-Aminosäuren, um Proteine herzustellen? Das ist gegenwärtig eins der größten Rätsel der Naturwissenschaft“ (DiGregorio BE (2006) Microbe 10, 471-475). Alte Mechanismen als neu auszugeben und so implizit zu unterstellen, das Phänomen sei naturalistisch erklärt, hilft nicht weiter.
- Als plausible Erklärungsmöglichkeit für das Phänomen der Homochiralität bleibt ein absichtliches Vorgehen seitens eines Schöpfers, so wie man auch heute durch gezieltes geplantes Vorgehen im Labor reine Enantiomere herstellen oder Racemate in Enantiomere trennen kann. Ein solches Vorgehen oder Eingriff kann man als „Manipulation“ bezeichnen. Wer „manipulierte“ und welcher Methodik er sich bediente, ist der Untersuchung natürlich nicht zugänglich. (Man beachte, dass „manipuliert“ bereits im kritisierten Artikel mit Bedacht in Anführungszeichen gesetzt wurde.) Eine „Wissenschaftslogik“, die Eingriffe von außen und planmäßiges Vorgehen von vornherein ausschließt, ist innerhalb ihrer Begrenzung ein sehr nützliches methodisches Werkzeug. Verabsolutiert wird sie zur Weltanschauung des Naturalismus, den sie nur im Sinne eines Zirkelschlusses „beweisen“ kann, weil sie von ihm definitionsmäßig gesetzt wurde. Damit aber würden die Grenzen der Methodik zur Grenze dessen, was wirklich sein kann.
Nachtrag vom 11. 4. 2007
- Inzwischen wurde ich darauf hingewiesen, dass der genannte Text von Dr. Beyer verändert wurde. Mit der Angabe „Last update: 30.03.07“ lautet er nun: „So werden neuere Erklärungsansätze bezüglich des ‘Chiralitätsproblems’ (wie etwa die bevorzugte Anreicherung eines bestimmten Stereoisomers an bestimmten Mineralien) nur unzureichend diskutiert und die Möglichkeit einer enzymatischen Razematspaltung oder eines auf ‚enantiomerreine’ Proteine oder homochirale Nucleinsäuren zusteuernden Selektionsprozesses, der z. B. aus Stabilitätsgründen alle ‚Mischvarianten’ aus dem Rennen wirft (enantioselektive Replikation), in dem Artikel von Imming gar nicht erst erwähnt. (Zur Frage der Entstehung von Chiralität siehe auch Plankensteiner K.; Reiner, H.; Rode, BM. (2004): From earth’s primitive atmosphere to chiral peptides – the origin of precursors for life. Chem Biodivers. 1(9), pp. 1308-15.).“
- Es ist erfreulich, dass die Kritik sehr rasch aktualisiert wurde und sich nun vorsichtiger gibt. Natürlich gibt es immer Artikel und Aspekte, die man nicht erwähnen kann, wenn man ein Thema zusammenfassend behandelt. So hätte Dr. Beyer auch den aktuellen Review der Rode-Gruppe nennen können (Fitz D et al. Curr. Chem. Biol. 2007, 1, 41-52).
- Die stichwortartige Aufzählung unterschiedlicher Versuche, Homochiralität naturalistisch zu erklären, könnte suggerieren, es gäbe viele Erklärungsmöglichkeiten. Das Gegenteil ist der Fall: Weil es bisher kein akzeptiertes Modell gibt, werden regelmäßig eine Reihe mindestens bisher gescheiterter Ansätze aufgezählt.
- Die Paritätsverletzung auf atomarer Ebene als Erklärung für die natürliche Homochiralität ist in „Die fehlenden Spiegelbilder“ (https://www.genesisnet.info/index.php?Artikel=42081&Sprache=de&l=2) behandelt und vor allem Bonners relevanter Review aus dem Jahr 2000 zitiert worden einschließlich seiner negativen Schlussfolgerung. Neuerdings wird die Paritätsverletzungs-Hypothese von der Arbeitsgruppe um B.M. Rode wieder aufgegriffen: Schwerere Atomkerne, z. B. Kupfer, führen zu größeren Energiedifferenzen aufgrund der Paritätsverletzung als leichtere Atome wie Kohlenstoff. Bei der Synthese von Dipeptiden in Gegenwart von Kupfer-Ionen durch wiederholtes Eindampfen und Wiederaufnehmen einer wässrigen Lösung entstand z. B. aus rac-Alanin ein Überschuss von ca. 10% des L-L-Dipeptids. Die Autoren postulieren, dieses Resultat sei möglicherweise auf Energieunterschiede durch Paritätsverletzung zurückzuführen. Jedenfalls sind auch diese Experimente sehr weit weg von einer Erklärung der natürlichen Homochiralität. Es seien nur einige wenige Schritte – eigentlich Sprünge – angedeutet, die gegangen werden müssten, um einer Erklärung näherzukommen:
– Wie verhalten sich Gemische von Aminosäuren? Lösungen reiner Aminosäuren sind äußerst artifiziell, so artifiziell, dass solche Experimente keineswegs auf den realeren Fall einer Mischung von Aminosäuren, Carbonsäuren und vielen anderen Molekülen extrapoliert werden können.
– Die Experimente führen nicht zu einem „Verschwinden“ der D-Aminosäuren, sondern dazu, dass etwas mehr L-Form am Kupfer-Ion komplexiert ist oder als Dimer vorliegt. (Die Ausbeute an Dipeptiden betrug nur ca. 2%.) Der „Rest“ ist nicht etwa „wegselektiert“ worden, sondern liegt in Lösung vor. Wie soll aus einer Mischung von monomeren und dimeren Aminosäuren erstens eine echte Kompartimentierung resultieren und zweitens ein Verschwinden der D-Isomere? Die „Möglichkeit einer enzymatischen Razematspaltung oder eines auf ’enantiomerreine’ Proteine oder homochirale Nucleinsäuren zusteuernden
Selektionsprozesses“ (A. Beyer) ist mehr als spekulativ.
Die Fragen könnten fortgesetzt werden. Weitere Forschungen sind also unbedingt nötig. Aber man sollte nicht kategorisch vertreten, dass der naturalistische Ansatz genügt, und nicht ausschließen, dass dieser Ansatz durch einen planenden Einfluss mindestens ergänzt werden muss.
Autor dieser News: Peter Imming
© 2007, http://www.genesisnet.info/schoepfung_evolution/n80.php
Zurück zur Artikel-Übersicht: https://www.wort-und-wissen.org/publikationen/genesisnet/
28.11.05 Neuer Artikel zum Thema „Entstehung des Lebens“
Eine wichtige Voraussetzung für Leben betrifft die genaue räumliche Gestalt lebensnotwendiger Moleküle. Aminosäuren, Zucker und sehr viele andere Lebens-Bausteine kommen in der Natur nur in einer von zwei spiegelbildlichen Formen vor bzw. nur die eine Form ist in einem bestimmten Organismus oder für eine bestimmte Funktion brauchbar. Diese molekulare Asymmetrie der Natur nennt man Homochiralität. Chiralität ist die Erscheinung, dass Moleküle oder sonstige Gegenstände in zwei zueinander spiegelbildlichen, nicht kongruenten (nicht identischen) Formen existieren können. Chiralität heißt übersetzt Händigkeit; denn die Hände sind ein Beispiel für chirale Objekte. Zwei zueinander spiegelbildliche Moleküle heißen Enantiomere, ein 1:1-Gemisch zweier Enantiomere Racemat.
So ähnlich sich Enantiomere sind – sie können sich gegenseitig nicht ersetzen. Eine Diät, die statt L- nur D-Aminosäuren enthielte, würde rasch zum Tode durch Mangelernährung führen. „L“ und „D“ bezeichnen eine von zwei gängigen chemischen Nomenklaturen, um sprachlich Enantiomere zu unterscheiden. Reine Enantiomere können im Labor hergestellt werden. Geht man von achiralen (nicht-chiralen) Ausgangsmaterialien aus, so muss man die chirale Information in irgendeiner Weise chemisch hineinbringen, sonst entstehen wieder nur Racemate. Eingebracht wird die Information, indem man auf enantiomerenreine Hilfsreagenzien, Katalysatoren o.ä. zurückgreift, die letztlich aus der Natur stammen.
Aber wie entstanden die enantiomerenreinen Substanzen, die wir in der Natur finden? Genau das ist eines der großen Naturrätsel. Vor der Entstehung von Lebewesen muss irgendwann die Entscheidung zugunsten der einen Sorte Enantiomerer gefallen sein. Auf der Ebene lebender Organismen führt die Konkurrenz von Individuen und Arten zu Selektionsprozessen. Bei Enantiomeren mit chemisch gleichem Energiegehalt existiert ein auf Konkurrenz basierender Selektionsprozess nicht. Daher ist prinzipiell unklar, wie es in einer hypothetischen präbiotischen* Welt zu einer Selektion kommen kann. Beide Alternativen sind dort gleich wahrscheinlich.
*präbiotisch (= vor der Existenz von Leben)
Eine natürliche Ursache dieses Naturphänomens ist schwer vorstellbar, wird aber gesucht. Dazu wurden verschiedene Erklärungshypothesen aufgestellt. Sie lassen sich in vier Gruppen einordnen, die im Artikel „Die fehlenden Spiegelbilder“ (https://www.genesisnet.info/index.php?Artikel=42081&Sprache=de&l=1) erläutert werden. Im Expertenteil (Die fehlenden Spiegelbilder, https://www.genesisnet.info/index.php?Artikel=42081&Sprache=de&l=2) werden diese Hypothesen ausführlich dargestellt. Es zeigt sich, dass alle diese Hypothesen ungeeignet sind, den Ursprung der lebensnotwendigen Homochiralität zu erklären.
Der Autor des Artikels, Professor Peter Imming, gelangt zu folgenden Schlussfolgerungen:
„Das Phänomen der Homochiralität wird … sofort verständlich, wenn wir nicht auf der Basis unseres Nicht-Wissens, sondern unseres Wissens an die Fragestellung herangehen. Wir wissen sehr genau, wie man reine Enantiomere und überhaupt die Moleküle des Lebens (Aminosäuren, Zucker, Proteine, RNS, DNS usw.) herstellen kann, unter welchen Bedingungen sie entstehen können, stabil sind oder zerfallen. Wir wissen auch, unter welchen Bedingungen sie eben nicht entstehen können. Wir können sie selbst herstellen und sehen, welche Chemie dafür erforderlich ist und welche es verhindert. Wir wissen, dass beispielsweise reine Enantiomere nicht von allein entstehen, sondern mittels gezielter Auswahl von Reagenzien, Reaktionsbedingungen, Reaktionsaufarbeitung und -abfolgen durch einen Experimentator.
Auf der Basis dieses unseres Wissens können wir schließen, dass auch die erste Entstehung der Moleküle des Lebens und ihr Zusammenbau zu einer Zelle gezielte Planung und Kreativität erforderte. Zielsetzung, Planung und Kreativität sind hier nicht ‘Lückenbüßer’ für etwas (noch) Unverstandenes, sondern logische Folgerung aus unserem experimentellen, in unzähligen Versuchen wissenschaftlich erworbenem Wissen um die Eigenschaften und Erfordernisse für die Moleküle des Lebens und für lebende Zellen. Wir wissen, dass es dafür absolut notwendig und unerlässlich ist, gezielt und geplant vorzugehen.
Die beste Erklärung für die Entstehung der Homochiralität ist also diejenige, die auf unserem Wissen um die Möglichkeiten der Entstehung dieses Phänomens basiert statt auf Spekulationen und Hypothesen. Die beste Erklärung ist: Jemand – ein Schöpfer – hat ‘manipuliert’, so wie es auch Chemikern durch kreative, gezielte Versuchsplanung und -durchführung gelingt, enantiomerenreine Substanzen herzustellen. Wir wissen, wie man reine Enantiomere herstellen kann – von alleine, de novo, ohne Voraussetzung von Leben, geschieht es nicht. Deshalb kann es nach allem, was wir wissen, auch ‘ganz am Anfang’ nicht von allein geschehen sein.“
Autor dieser News: Reinhard Junker
© 2005, http://www.genesisnet.info/schoepfung_evolution/n53.php
Zurück zur Artikel-Übersicht: https://www.wort-und-wissen.org/publikationen/genesisnet/
28.10.04 Fünf neue Beiträge zum Thema „Entstehung des Lebens“
Wie könnte das Leben entstanden sein? Diese Frage hat die Phantasie des Menschen schon immer beschäftigt und ist bis heute eine Herausforderung für den menschlichen Verstand. In fünf neuen Beiträgen werden einige Aspekte dieser für die Evolutionslehre grundlegenden Frage behandelt.
Was ist „Leben“ überhaupt und welche Methoden stehen zur Erforschung der Frage zur Verfügung? ist das Thema von „Eingrenzung der Fragestellung“ (https://www.genesisnet.info/index.php?Artikel=42021&Sprache=de&l=1). In „Geschichtliches zur präbiotischen Chemie“ (https://www.genesisnet.info/index.php?Artikel=42022&Sprache=de&l=1) werden ein kurzer Überblick über frühere Vorstellungen zur Lebensentstehung gegeben und neuere Bemühungen, die Entstehung des Lebens aufzuklären, geschildert.
Weshalb die Frage der Entstehung der Nukleinsäuren (DNS-Molekül, das die Erbinformation trägt) völlig ungelöst ist, wird in „Entstehung von Nukleinsäuren“ (https://www.genesisnet.info/index.php?Artikel=42063&Sprache=de&l=1) erläutert.
In einem weiteren Beitrag geht es um die „Entstehung von Zellmembranen“ (https://www.genesisnet.info/index.php?Artikel=42063&Sprache=de&l=1). Ohne Abgrenzung von der Umwelt wäre Leben unmöglich. Mit der Abgrenzung ist zugleich aber auch die Fähigkeit zum Stoffaustausch mit der Umgebung erforderlich. Abgrenzung und Stoffaustausch werden gleichzeitig benötigt. Wie solche Gebilde erstmals zufällig entstanden sein könnten, ist unbekannt.
Das „Henne-Ei-Problem“ (Was war zuerst da: Henne oder Ei?) gibt es auch in der präbiotischen Chemie*: Was war zuerst da: Proteine oder Nukleinsäuren? Beide Komponenten sind in allen heute bekannten Zellen unverzichtbare Bestandteile und werden ebenfalls gleichzeitig benötigt. Es ist unverstanden, wie dieses Problem unter präbiotischen Bedingungen gelöst werden kann. Das wird im Artikel „RNS-Welt“ (https://www.genesisnet.info/index.php?Artikel=42101&Sprache=de&l=1) gezeigt.
*präbiotische Chemie (= Forschungszweig, in dem chemische Prozesse untersucht werden, die vor dem Auftreten erster Lebewesen abgelaufen sein und damit die materielle Basis für die Entstehung erster lebender Systeme liefern könnten)
Autor dieser News: Reinhard Junker
© 2004, http://www.genesisnet.info/schoepfung_evolution/n27.php
Zurück zur Artikel-Übersicht: https://www.wort-und-wissen.org/publikationen/genesisnet/
05.05.04 Erste Artikel im Fachgebiet Entstehung des Lebens (Präbiotische Chemie)
Die Frage nach der erstmaligen Entstehung des Lebens gehört zu den grundlegenden Themen der Evolutionsbiologie. Heute gilt: Alles Leben entsteht nur aus Leben: Omne vivum ex vivo. Etwas anderes wurde nie beobachtet. Dennoch soll es auf der hypothetischen frühen Erde anders gewesen sein: Leben soll dort durch natürliche Vorgänge aus nichtlebenden Stoffen entstanden sein.
In einem ersten Artikel zu dieser Thematik wird die Zusammensetzung der Uratmosphäre diskutiert („Hypothesen zur Uratmosphäre“, https://www.genesisnet.info/index.php?Artikel=42041&Sprache=de&l=1). Eine geeignete Uratmosphäre ist eine notwendige (nicht ausreichende!) Bedingung für die abiotische Entstehung des Lebens (abiotisch heißt: ohne Vorgabe des Lebens).
Darauf aufbauend wird in Simulationsexperimenten versucht, Moleküle der Lebewesen aus anorganischen Ausgangsstoffen unter Energieeinwirkung herzustellen („Ursuppen-Simulationsexperimente“, https://www.genesisnet.info/index.php?Artikel=42042&Sprache=de&l=1). Bei solchen „Ursuppen“-Simulationsexperimenten entstehen u. a. Aminosäuren, die in Lebewesen vorkommen. Darüber hinaus bilden sich immer auch zahlreiche Stoffe, die nachfolgende Schritte zu Proteinen (Eiweißen) verhindern. Es hat sich gezeigt, dass solche Experimente in Sackgassen führen („Entstehung von Proteinen“, https://www.genesisnet.info/index.php?Artikel=42061&Sprache=de&l=1).
Autor dieser News: Reinhard Junker
© 2004, http://www.genesisnet.info/schoepfung_evolution/n18.php
Zurück zur Artikel-Übersicht: https://www.wort-und-wissen.org/publikationen/genesisnet/